Mengenal Virus Nipah: Sejarah, Transmisi, dan Gejala Klinis
Penyakit zoonosis merupakan penyakit yang menular dari hewan ke manusia dan menjadi tantangan besar dalam kesehatan global saat ini. Salah satu patogen yang menjadi perhatian utama adalah virus Nipah (NiV).
A. Pengenalan dan Sejarah Virus Nipah (NiV)
Penelitian mengenai epidemiologi Virus Nipah (NiV) telah berkembang menjadi bidang investigasi yang kritis, didorong oleh patogenisitasnya yang tinggi dan dampak kesehatan masyarakat yang signifikan di seluruh Asia Selatan dan Tenggara. Sejak pertama kali diidentifikasi di Malaysia pada tahun 1998, virus ini telah menyebabkan wabah berulang yang ditandai dengan penyakit pernapasan dan neurologis yang parah. Virus Nipah (NiV) merupakan patogen zoonosis yang diklasifikasikan sebagai agen Biosafety Level-4 (BSL-4) karena tingkat fatalitasnya yang tinggi dan ketiadaan terapi yang efektif. Virus ini termasuk dalam genus Henipavirus di bawah famili Paramyxoviridae dan memiliki materi genetik berupa RNA untai tunggal negative-sense yang tidak bersegmen. Genom virus ini terdiri dari enam gen yang tersusun secara berurutan, yaitu nucleocapsid (N), phosphoprotein (P), matrix (M), fusion (F), glycoprotein (G), dan large polymerase (L).
B. Struktur Virus Nipah (NiV)
Virus Nipah (NiV) adalah paramyxovirus (genus Henipavirus, subfamili Paramyxovirinae, famili Paramyxoviridae, ordo Mononegavirales), sebuah virus baru (emerging virus) yang dapat menyebabkan penyakit pernapasan parah dan ensefalitis mematikan pada manusia. Ini adalah virus RNA berenvelop, tidak bersegmen, berutas tunggal (single-stranded), dengan sense negatif, yang memiliki simetri heliks.
Genom RNA, dari ujung 3′ ke 5′, berisi susunan berurutan dari enam gen, yaitu: nucleocapsid (N), phosphoprotein (P), matrix (M), fusion glycoprotein (F), attachment glycoprotein (G), dan long polymerase (L). Protein N, P, dan L melekat pada RNA virus membentuk ribonukleoprotein virus (vRNP). Protein F dan G bertanggung jawab atas perlekatan seluler virion dan masuknya virus ke dalam sel inang selanjutnya.
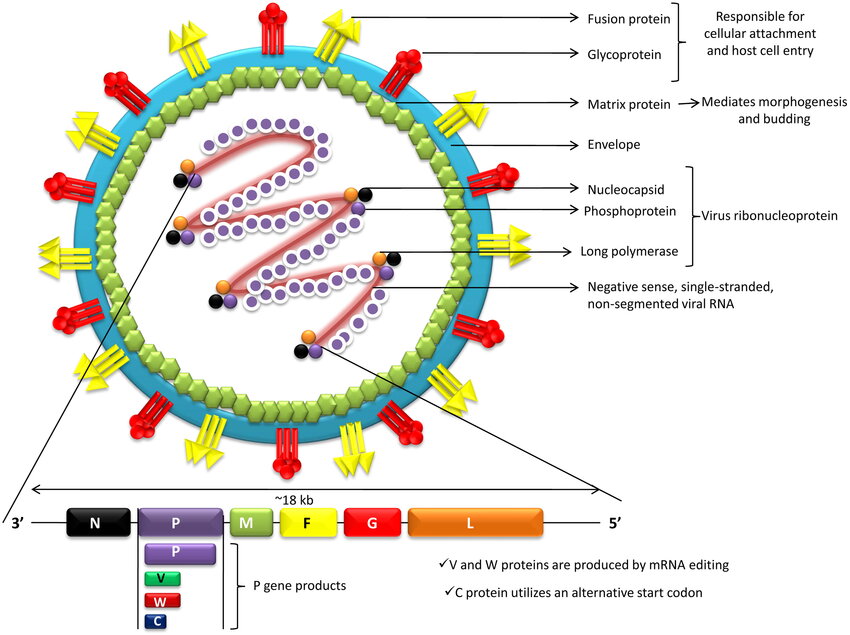
NiV menginfeksi sel inangnya melalui dua glikoprotein, yaitu protein G dan F. Genom ini mengkode enam protein utama secara berurutan, namun kunci infektivitasnya terletak pada kerja sama antara Glikoprotein G dan F. Mekanisme masuknya virus ke dalam sel inang dimulai ketika protein G berikatan dengan reseptor spesifik pada permukaan sel inang, yaitu ephrin-B2 atau ephrin-B3. Ikatan ini memicu perubahan bentuk (konformasi) pada protein G yang kemudian mengaktifkan protein F untuk melakukan fusi atau peleburan antara membran virus dan sel inang, memungkinkan materi genetik virus masuk dan memulai infeksi. Analisis filogenetik mengonfirmasi adanya dua clade utama virus yang bersirkulasi: NiV-MY (mencakup isolat dari Malaysia dan Kamboja) serta NiV-BD (mencakup isolat dari Bangladesh dan India).
Dalam aspek ketahanan lingkungan, NiV menunjukkan stabilitas yang patut diwaspadai karena mampu bertahan hidup selama beberapa hari dalam media yang kaya gula, seperti nira kurma buatan atau jus buah, serta memiliki waktu paruh 18 jam dalam urin kelelawar. Meskipun virus ini resisten terhadap pemanasan 70°C selama satu jam, ia dapat diinaktivasi sepenuhnya jika dipanaskan hingga 100°C selama lebih dari 15 menit atau jika terpapar agen pembersih umum seperti sabun, deterjen, dan natrium hipoklorit. Karakteristik stabilitas ini menjelaskan mengapa penularan melalui bahan pangan yang terkontaminasi menjadi rute penyebaran yang signifikan dalam wabah-wabah tertentu.
Pada tingkat seluler dan patogenesis, virus ini menyerang epitel saluran pernapasan manusia yang memiliki ekspresi tinggi reseptor ephrin-B2, yang kemudian memicu gejala pernapasan berat. Tingkat keparahan infeksi diperburuk oleh kemampuan virus untuk memanipulasi sistem pertahanan inang; misalnya, protein aksesori V diketahui mampu menekan induksi interferon (sistem imun bawaan), sementara protein Matriks (M) dan Nukleokapsid (N) membajak mesin seluler untuk memfasilitasi replikasi dan perakitan partikel virus baru. Pemahaman mendalam mengenai interaksi protein virus dengan inang ini, termasuk bagaimana virus menghambat jalur perbaikan DNA seluler, menjadi landasan krusial bagi para peneliti dalam merancang target obat dan vaksin yang efektif di masa depan.
C. Transmisi, Stabilitas, dan Ekologi Reservoir
Dinamika penularan virus ini sangat dipengaruhi oleh stabilitasnya di lingkungan. Studi menunjukkan bahwa virus Nipah dapat bertahan hidup hingga 3 hari dalam jus buah atau mangga, dan setidaknya 7 hari dalam getah kurma buatan pada suhu 22°C. Di alam liar, virus ini memiliki waktu paruh sekitar 18 jam dalam urin kelelawar, yang memungkinkan penularan berkelanjutan. Reservoir alami utama adalah kelelawar buah dari genus Pteropus, khususnya spesies P. vampyrus dan P. hypomelanus.
Peran Kelelawar Sebagai Inang Reservoir Alami
Kelelawar buah, khususnya dari genus Pteropus, telah teridentifikasi sebagai inang reservoir alami bagi beberapa patogen berisiko tinggi, termasuk virus Nipah, Rabies, dan Marburg. Menariknya, studi evolusioner menunjukkan bahwa virus-virus ini telah beradaptasi dengan sangat baik di dalam tubuh kelelawar, sehingga kelelawar pembawa virus tidak menunjukkan gejala sakit atau perubahan patologis yang signifikan. Namun, bahaya muncul ketika terjadi fenomena limpahan (spillover), di mana virus melintasi hambatan spesies dan menular ke hewan lain atau manusia.
Mekanisme Penularan: Peran Inang Perantara dan Pangan
Transmisi virus Nipah ke manusia umumnya terjadi melalui dua jalur utama yang sangat dipengaruhi oleh faktor geografis dan ekologis, diantaranya :
- Jalur Inang Perantara (Model Wabah Malaysia)
Di wilayah seperti Malaysia, babi berperan sebagai inang penguat (amplifying hosts). Penularan bermula dari kedekatan lokasi antara peternakan babi dengan pohon buah-buahan yang menjadi habitat kelelawar. Kelelawar menjatuhkan sisa buah yang terkontaminasi air liur atau urin, yang kemudian dimakan oleh babi. Babi yang terinfeksi ini kemudian menularkan virus secara masif kepada manusia, terutama peternak yang memiliki kontak erat. Investigasi membuktikan bahwa 92% pasien manusia memiliki riwayat kontak dengan babi, dan wabah baru berhenti setelah dilakukan pemusnahan babi secara massal. Hewan domestik lain seperti sapi dan kambing juga dapat menjadi perantara melalui mekanisme serupa. - Jalur Kontaminasi Pangan (Model Wabah Bangladesh)
Di Bangladesh, jalur penularan utama terjadi melalui konsumsi nira kurma segar atau yang difermentasi (tari). Studi menggunakan kamera inframerah merekam aktivitas kelelawar Pteropus yang menjilati aliran nira langsung dari pohon saat proses penyadapan. Virus Nipah memiliki stabilitas tinggi dan mampu bertahan hidup selama berhari-hari dalam larutan kaya gula pada suhu sejuk. Akibatnya, kasus infeksi pada manusia sering kali bersifat musiman, muncul setiap musim dingin (Desember-Maret) saat panen nira berlangsung.
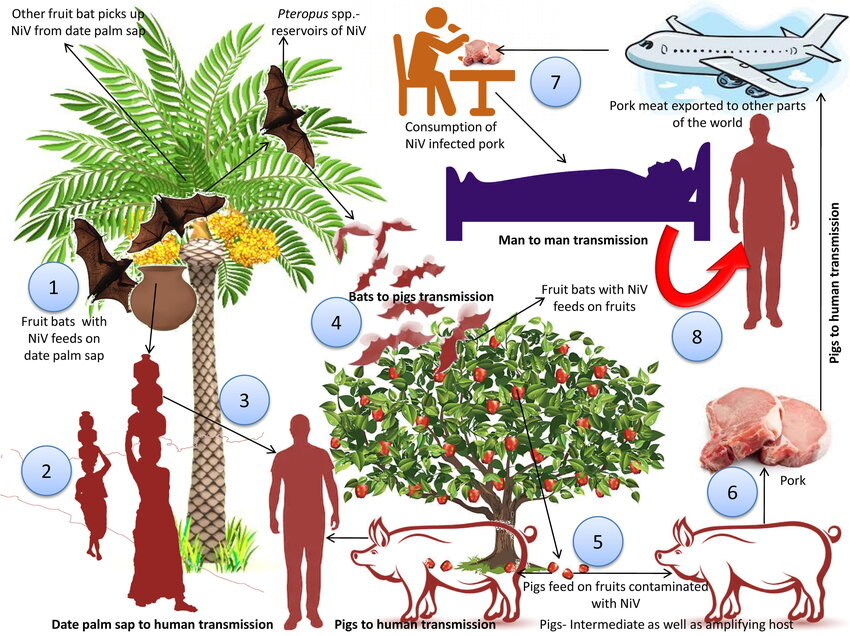
Penularan Viruh Nipah (NiV) : 1) Kelelawar buah bertindak sebagai reservoar alami virus Nipah yang memakan nira kurma, di mana virus dapat bertahan dalam larutan kaya gula seperti daging buah; 2) Virus ditularkan ke manusia melalui konsumsi nira kurma; 3) Kelelawar buah spesies Pteropus mengunjungi pohon buah dan menumpahkan cairan mengandung virus yang mengontaminasi tanah serta buah-buahan di kebun; 4) Buah yang terkontaminasi dikonsumsi oleh babi (sebagai inang perantara dan penguat) serta hewan lain, yang bersama dengan faktor lingkungan membentuk dasar penyebaran virus; 5) Daging babi yang terinfeksi diekspor ke wilayah lain; 6) Konsumsi daging babi yang terinfeksi menjadi sumber penularan bagi manusia; 7) Kontak erat dengan manusia yang terinfeksi dapat menyebabkan penyebaran virus ke orang lain.
Transmisi Sekunder dan Risiko Antar-Manusia
Setelah virus berhasil masuk ke populasi manusia, risiko penularan sekunder dari manusia ke manusia menjadi ancaman serius. Transmisi ini umumnya terjadi melalui kontak langsung dengan sekresi tubuh pasien (seperti droplet pernapasan atau urin), yang menempatkan keluarga dan tenaga medis pada risiko tinggi. Penelitian eksperimental terbaru pada hamster bahkan mengindikasikan bahwa paparan aerosol dalam jarak dekat turut berperan dalam penyebaran virus ini. Sayangnya, di beberapa komunitas/wilayah, kurangnya pemahaman ilmiah menyebabkan penyakit ini sempat dianggap sebagai gangguan supranatural, yang menghambat penanganan medis yang tepat.
Faktor Ekologis dan Langkah Pencegahan
Pemicu utama dari semua skenario penularan ini adalah perubahan ekologis. Kerusakan habitat alami, perubahan pola makan, dan pergeseran wilayah jelajah memaksa kelelawar untuk mencari makan di area pertanian dan pemukiman manusia. Kedekatan fisik antara manusia, hewan ternak, dan satwa liar inilah yang memfasilitasi terjadinya spillover. Oleh karena itu, strategi pencegahan tidak hanya berfokus pada aspek medis, tetapi juga pengendalian lingkungan seperti mencegah akses kelelawar terhadap nira kurma dan membatasi interaksi fisik antara peternakan dengan habitat satwa liar serta edukasi publik yang efektif.
D. Patogenesis & Gejala Klinis
Case Fatality Rate (CFR) & Patogenesis
Tingkat Kematian Kasus atau Case Fatality Rate (CFR) virus Nipah bervariasi antara 40% hingga 75%, namun pada beberapa wabah tertentu dapat mencapai 92%, tergantung pada fasilitas kesehatan dan galur virus. Secara patogenesis, virus masuk melalui saluran pernapasan, menginfeksi epitel bronkiolus, kemudian menyebar ke pembuluh darah (viremia) dan menyerang organ target seperti paru-paru, limpa, ginjal, dan otak. Di otak, virus menyebabkan kerusakan sawar darah-otak (Blood-Brain Barrier/BBB), memicu ekspresi sitokin inflamasi seperti IL-1β dan TNF-α yang berujung pada tanda-tanda neurologis fatal.
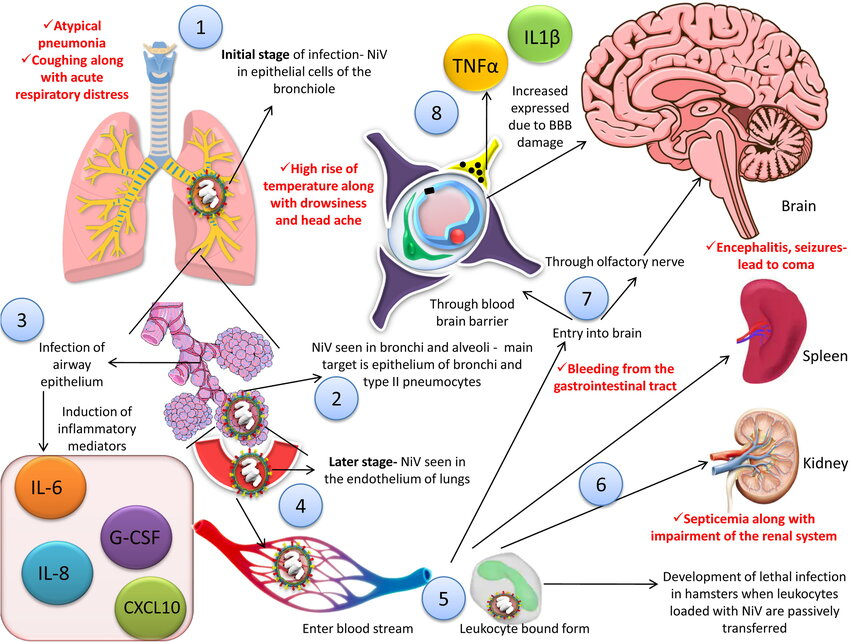
Patogenesis dari NiV:
1) NiV dapat terlihat pada sel-sel epitel bronkiolus pada tahap awal infeksi; 2) Antigen NiV dapat dideteksi pada bronkus dan alveoli; 3) Mediator inflamasi diaktifkan sebagai akibat dari infeksi pada epitel saluran napas; 4) Virus menyebar ke sel-sel endotel paru-paru pada tahap penyakit selanjutnya; 5,6) Virus masuk ke dalam aliran darah diikuti dengan penyebaran, baik secara bebas maupun dalam bentuk terikat pada leukosit inang, hingga mencapai otak, limpa, dan ginjal; 7) Dua jalur terlibat dalam proses masuknya virus ke sistem saraf pusat (SSP), yaitu melalui rute hematogen dan secara anterograd melalui saraf olfaktori; 8) Sawar darah otak (Blood Brain Barrier/BBB) terganggu serta IL-1b dan tumor necrosis factor (TNF)-a diekspresikan akibat infeksi SSP oleh virus yang pada akhirnya menyebabkan munculnya tanda-tanda neurologis.
Penting untuk dicatat bahwa virus dapat secara langsung masuk ke SSP pada beberapa model hewan percobaan melalui saraf olfaktori. Epitel olfaktori pada turbinat hidung terinfeksi oleh NiV pada model hewan tersebut. Infeksi virus kemudian meluas melalui lempeng kribiformis (cribriform plate) menuju bulbus olfaktorius. Pada akhirnya, virus menyebar ke seluruh korteks ventral bersama dengan tuberkulum olfaktorius.
Tanda Klinis dan Gejala
NiV yang sangat patogen menyebabkan infeksi bergejala pada babi dan manusia. Gejala pernapasan jauh lebih parah pada babi dibandingkan dengan manusia.
Gejala Klinis pada Manusia
Virus ini bertanggung jawab menyebabkan penyakit yang parah dan berkembang cepat pada manusia, dengan sistem pernapasan serta sistem saraf pusat (SSP) menjadi bagian utama yang terdampak. Tanda dan gejala penyakit muncul 3–14 hari pasca paparan NiV.
- Gejala Awal
Awalnya, terjadi kenaikan suhu tubuh yang tinggi disertai rasa kantuk dan sakit kepala. - Gejala Lanjutan
Hal ini diikuti oleh kebingungan mental serta disorientasi, yang pada akhirnya berkembang menjadi koma dalam waktu 1–2 hari. Komplikasi kritis dari infeksi NiV adalah ensefalitis (radang otak). - Gangguan Pernapasan
Selama fase awal, masalah pernapasan mungkin menjadi jelas. Terjadi perkembangan pneumonia atipikal. Batuk disertai gangguan pernapasan akut (acute respiratory distress) mungkin terlihat pada pasien tertentu. Penting untuk dicatat bahwa penularan virus lebih umum terjadi dari pasien yang mengalami kesulitan bernapas dibandingkan mereka yang tidak memiliki masalah pernapasan. - Gejala Lainnya
Mungkin terdapat sakit tenggorokan, muntah, disertai nyeri otot. Mungkin terjadi perkembangan septikemia (keracunan darah) disertai gangguan sistem ginjal dan pendarahan dari saluran pencernaan. - Kasus Parah
Pada kasus yang parah dalam periode 24–48 jam, mungkin terjadi perkembangan ensefalitis disertai kejang yang pada akhirnya menyebabkan koma.
Gejala Klinis pada Hewan Babi
Penyakit ini juga dikenal sebagai porcine respiratory and encephalitis syndrome (PRES), barking pig syndrome (BPS) (di semenanjung Malaysia), atau one-mile cough.
- Penyakit demam akut telah dilaporkan pada babi berusia di bawah enam bulan, di mana terjadi perkembangan penyakit pernapasan yang berkisar dari napas berat yang cepat hingga batuk non-produktif (tidak berdahak) yang suaranya keras.
- Kecuali pada anak babi muda, tingkat kematian relatif rendah. Namun, pada hewan yang dikurung, tingkat kesakitan (morbiditas) dapat mendekati 100 persen.
- Karena keterlibatan sistem saraf, mungkin terjadi kedutan otot, kelemahan kaki belakang, tremor, serta paresis (kelumpuhan parsial), baik yang bersifat flaccid (lemas) maupun spastic (kaku), dengan berbagai tingkatan. Mungkin juga terdapat Nystagmus (gerakan bola mata cepat) serta kejang pada babi jantan maupun induk babi.
Gejala Klinis pada Hewan Lain
- Anjing: terjadi peradangan paru-paru disertai nekrosis glomerulus serta tubulus dengan pembentukan sinsitium di ginjal.
- Kucingv: terjadi perkembangan sinsitium endotel disertai vaskulopati di berbagai organ.
- Hewan Percobaanv: Infeksi eksperimental NiV pada berbagai hewan, yaitu hamster, marmut (guinea-pig), embrio ayam, serta monyet hijau Afrika, menghasilkan perkembangan lesi pada parenkim di SSP disertai vaskulopati.
- Tikus/Mencitv: Tanda klinis tampaknya tidak muncul pada mencit maupun tikus karena alasan yang belum diketahui.
E. Kemajuan Diagnosis
Diagnosis laboratorium memerlukan fasilitas keamanan tinggi (BSL-4) untuk isolasi virus, namun deteksi molekuler dapat dilakukan dengan RT-PCR dan Real-time RT-PCR yang menargetkan gen N. Metode serologis seperti Antigen Capture ELISA dan IgM Capture ELISA juga digunakan untuk skrining cepat. Terkait pengobatan, saat ini belum ada obat yang disetujui, namun penelitian terbaru menunjukkan beberapa kandidat menjanjikan:
- Antibodi Monoklonal m102.4
Antibodi manusiawi ini terbukti efektif memberikan perlindungan penuh pada model primata (African green monkeys) jika diberikan pada fase awal infeksi. - Favipiravir (T-705)
Obat antivirus ini menunjukkan efektivitas dalam melindungi hamster dari dosis letal virus Nipah. - Ribavirin
Meskipun digunakan secara empiris dalam beberapa wabah, efektivitasnya masih diperdebatkan dan belum terbukti konsisten pada model hewan.
F. Pencegahan dan Strategi Vaksin Masa Depan
Strategi pencegahan utama tetap berfokus pada pendekatan One Health, yang mencakup perlindungan area penyadapan getah kurma dari akses kelelawar dan peningkatan biosekuriti peternakan babi. Di bidang vaksinasi, Coalition for Epidemic Preparedness Innovations (CEPI) telah memprioritaskan pengembangan vaksin NiV. Beberapa platform vaksin sedang dalam tahap pengembangan lanjut seperti :
- Vaksin virus campak rekombinan (rMV) yang mengekspresikan glikoprotein selubung NiV telah ditemukan sebagai kandidat vaksin yang efektif.
- Vaksin Vektor VSV: Vaksin berbasis Vesicular Stomatitis Virus : (kompeten bereplikasi) telah dikembangkan dalam beberapa tahun terakhir yang mengodekan glikoprotein NiV.
- Virus-Like Particles (VLPs) yang terdiri dari tiga protein NiV, yaitu G, F, dan M yang berasal dari sel mamalia, telah diproduksi dan divalidasi sebagai vaksin pada mencit BALB/c.
- Kemajuan imunoinformatika telah dimanfaatkan untuk mengembangkan vaksin NiV berbasis peptida melalui prediksi dan pemodelan epitop sel T dari protein antigenik NiV.
Kesimpulan
Virus Nipah (NiV) merupakan patogen zoonosis prioritas tinggi yang diklasifikasikan sebagai agen Biosafety Level-4 (BSL-4) karena tingkat fatalitasnya yang ekstrem dan potensi pandeminya. Sejak kemunculan pertamanya di Malaysia pada tahun 1998, virus ini telah berevolusi menjadi ancaman kesehatan global dengan tingkat kematian kasus (CFR) berkisar antara 40% hingga lebih dari 75%, bergantung pada wabah dan fasilitas kesehatan setempat. Secara ekologis, kelelawar buah dari genus Pteropus bertindak sebagai reservoir alami yang memelihara siklus virus di alam liar. Dinamika penularan ke manusia sangat kompleks dan bervariasi secara geografis: di Malaysia, babi berperan sebagai inang perantara yang memperkuat virus (amplifying host), sementara di Bangladesh dan India, jalur utama melibatkan konsumsi getah kurma mentah yang terkontaminasi urin atau air liur kelelawar. Kemampuan virus untuk menular antarmanusia, terutama melalui sekresi pernapasan, menambah urgensi dalam pengendalian infeksi nosokomial.
Dari sisi klinis, NiV menyebabkan penyakit sistemik yang parah. Pada manusia, infeksi berkembang cepat dari gejala mirip flu menjadi ensefalitis fatal dan sindrom pernapasan akut, dengan risiko gejala sisa neurologis jangka panjang pada penyintas. Pada hewan ternak, khususnya babi, sindrom ini dikenal sebagai Barking Pig Syndrome, yang ditandai dengan batuk keras dan gangguan saraf, yang berdampak besar pada ekonomi peternakan.
Tantangan terbesar saat ini adalah ketiadaan terapi dan vaksin berlisensi untuk manusia. Pengobatan masih bersifat suportif, meskipun riset menunjukkan potensi pada antibodi monoklonal (m102.4) dan antivirus seperti Favipiravir. Oleh karena itu, strategi pengendalian yang paling efektif bertumpu pada pendekatan One Health yang mengintegrasikan surveilans kesehatan manusia, hewan, dan lingkungan untuk memutus rantai spillover dari satwa liar. Peningkatan biosekuriti, edukasi masyarakat untuk menghindari konsumsi getah kurma mentah, serta pengembangan diagnostik cepat adalah kunci untuk mencegah wabah di masa depan.
Referensi
- Alla, D., Shah, D. J., Adityaraj, N., Vagdevi, M., Alla, S. S. M., Sree, K., … & Issaka, Y. (2024). A systematic review of case reports on mortality, modes of infection, diagnostic tests, and treatments for Nipah virus infection. Medicine, 103(40), e39989.
- Ang, B. S., Lim, T. C., & Wang, L. (2018). Nipah virus infection. Journal of clinical microbiology, 56(6), 10-1128.
- Arunkumar, G., Chandni, R., Mourya, D. T., Singh, S. K., Sadanandan, R., Sudan, P., & Bhargava, B. (2019). Outbreak investigation of Nipah virus disease in Kerala, India, 2018. The Journal of infectious diseases, 219(12), 1867-1878.
- Bruno, L., Nappo, M. A., Ferrari, L., Di Lecce, R., Guarnieri, C., Cantoni, A. M., & Corradi, A. (2022). Nipah virus disease: epidemiological, clinical, diagnostic and legislative aspects of this unpredictable emerging zoonosis. Animals, 13(1), 159.
- Clayton, B. A. (2017). Nipah virus: transmission of a zoonotic paramyxovirus. Current opinion in virology, 22, 97-104.
- Geisbert, T. W., Mire, C. E., Geisbert, J. B., Chan, Y. P., Agans, K. N., Feldmann, F., … & Broder, C. C. (2014). Therapeutic treatment of Nipah virus infection in nonhuman primates with a neutralizing human monoclonal antibody. Science translational medicine, 6(242), 242ra82-242ra82.
- Goh, K. J., Tan, C. T., Chew, N. K., Tan, P. S. K., Kamarulzaman, A., Sarji, S. A., … & Lam, S. K. (2000). Clinical features of Nipah virus encephalitis among pig farmers in Malaysia. New England Journal of Medicine, 342(17), 1229-1235.
- Luby, S. P., Hossain, M. J., Gurley, E. S., Ahmed, B. N., Banu, S., Khan, S. U., … & Rahman, M. (2009). Recurrent zoonotic transmission of Nipah virus into humans, Bangladesh, 2001–2007. Emerging infectious diseases, 15(8), 1229.
- Nor, M., Gan, C. H., & Ong, B. L. (2000). Nipah virus infection of pigs in peninsular Malaysia. Revue scientifique et technique (International Office of Epizootics), 19(1), 160-165.
- Rahman, M. A., Shanjana, Y., Cronmiller, S., Zong, D., Davis, R., Ernest, J., … & Islam, M. R. (2024). Risk Evaluation and Mitigation Strategies for Potential Outbreaks of Nipah Virus Infection: Evidenced by the Recent Incidences in Southeast Asian Countries. Health Science Reports, 7(12), e70239.
- Satterfield, B. A. (2017). The future of preventing and treating Nipah virus infection. Future Science OA, 3(4), FSO220.
- Singh, R. K., Dhama, K., Chakraborty, S., Tiwari, R., Natesan, S., Khandia, R., … & Mourya, D. T. (2019). Nipah virus: epidemiology, pathology, immunobiology and advances in diagnosis, vaccine designing and control strategies–a comprehensive review. Veterinary Quarterly, 39(1), 26-55.
- Veggalam, S., Ca, J., Balaji, O., Thipani Madhu, M., Hussain, M. H., Gr, M., … & Kandi, V. (2025). Nipah Virus Outbreaks in India: A Comprehensive Update. Cureus, 17(9), e92420-e92420.

