Ikatan Kimia
Pengantar
Ikatan kimia merupakan ilmu kimia yang paling fundamenal untuk menjelaskan tentang suatu molekul maupun suatu reaksi. Tanpa memahami ikatan kimia, para ilmuwan tidak akan dapat menjelaskan mengapa atom saling tarik-menarik antara satu dengan lainnya atau bagaimana suatu produk terbentuk setelah terjadinya reaksi kimia. Untuk memahami konsep ikatan kimia, pertama-tama kita harus mengetahui dasar-dasar di balik struktur atom.
Gagasan yang membantuk terbangunnya pemahaman terkait iaktan kimia dimulai pada awal abad ke-20, setelah elektron ditemukan dan mekanika kuantum telah menyediakan bahasa untuk mendeskripsikan perilaku elektron dalam atom. Namun, meskipun ahli kimia membutuhkan mekanika kuantum untuk mencapai pemahaman terkait dengan pembentukan ikatan, sebagian besar pemahaman pragmatis tentang ikatan kimia telah diungkapkan dalam model intuitif sederhana. Jenis ikatan yang paling mungkin terjadi antara dua atom dapat diprediksi berdasarkan lokasi unsur-unsur dalam tabel periodik dan sampai pada batas tertentu sifat zat yang terbentuk dapat dikaitkan dengan jenis ikatan
Konsep kunci dalam diskusi tentang ikatan kimia adalah konsep molekul. Molekul merupakan unit terkecil dari senyawa yang dapat eksis. Salah satu fitur molekul yang dapat diprediksi adalah bentuknya. Bentuk molekul sangat peting untuk memahami reaksi yang dapat dialami senyawa, sehingga hubungan antara ikatan kimia dan reaktivitas kimia perlu juga dipahami. Mesikpun model ikatan sederhana berguna sebagai aturan praktis untuk merasionalisasi keberadaan senyawa dan sifat fisik dan kimia serta struktur molekul, para ilmuwan memerlukan justifikasi yang lebih canggih. Selain itu, ada beberapa aspek struktur molekul yang berada di luar cakupan teori sederhana. Untuk mencapai pemahaman ini, perlu menggunakan deskripsi mekanika kuentum sepenuhnya. Dalam praktiknya, deskripsi ini sangat bergantung pada komputer. Pendekatan numerik seperti itu pada ikatan kimia memberikan informasi penting terkait dengan ikatan kimia.
Untuk membahas secara rinci tentang struktur dan sifat atom, maka lihat lah atom. Sebuah atom umumnya mengandung inti yang terdiri dari proton dan neuron, dengan elektron dalam pada tingkat energi tertentu yang berputar di sekitar inti. Sekarang kita fokus pada elektron-elektron ini. Setiap unsur dapat dibedakan antara satu dengan yang lainnya karena adanya elektron yang mengelilinginya. Karena setiap unsur memiliki elektron yang berbeda, hal ini menyebabkan perbedaan sifat kimia serta tingkat reaktivitasnya. Dalam ikatan kimia, hanya elektron valensi, elektron yang terletak pada tingkat orbital energi terluar suatu unsur, yang terlibat.
Tinjauan Sejarah
Orang yunani awal, terutama Democritus, berpendapat bahwa materi terdiri dari partikel dasar yang disebut atom. Pandangan para atomis tidak memiliki otoritas yang berasal dari eksperimen serta bukti keberadaan atom tidak muncul selama dua millenium hingga munculnya ilmu kuantitatif dan sains empiris pada abad ke-18.
Teori Atom Dalton
Masa kimia modern diawali sejak pengajuan teori atom Jhon Dalton dalam bukunya “new system of chemical philosophy” pada tahun 1808. Jauh sebelum Dalton, sebenarnya beberapa teori telah diajukan oleh ilmuwan seperti Leucippos dan dilanjutkan oleh Democritos pada abad ketiga sebelum masehi. Akan tetapi, teori Dalton ini sangat melengkapi dan cocok serta dapat diterima oleh seluruh ilmuwan kimia. Menurut Dalton, atom merupakan partikel terkecil yang tidak dapat dibagi lagi. Atom suatu unsur yang sama memiliki bobot yang sama, sedang unsur yang berbeda, maka bobot atomnya akan berbeda juga. Senyawa dikiatakan sebagai hasil dari penggabungan atom-atom yang tidak sama dengan perbandingan bobot yang proporsional dengan bobot atom yang bergabung itu. Reaksi kimia hanya melibatkan penataan ulang atom-atom sehingga tidak ada atom yang berubah akibat reaksi kimia. Kata atom sebenarnya berasal dari bahasa latin Atomos, yang berarti tidak dapat dibelah lagi. Teori atom Dalton tidak menjelaskan adanya listrik dalam partikel atom.
Fitur Ikatan (Valensi)
Para ahli kimia Abad ke-19 membentuk sejumlah besar informasi empiris yang mengarah pada realisasi bahwa terdapat pola dalam senyawa yang dibentuk dalam unsur-unsur. Karakteristik yang paling berguna dari elemen ini adalah valensi, yang pada awalnya didefenisikan dalam hal jumlah maksimum atom hidrogen yang dapat melekat pada elemen atom. Hidrogen dipilih sebagai probe valensi karena peneliti menemukan bahwa atom hidrogen tidak pernah ditemukan dalam kombinasi dengan lebih dari satu atom lainnya, sehingga senyawa ini dianggap sebagai unsur primitif. Dengan cara ini, ditetapkan bahwa oksigen (O) biasanya memiliki valensi 2 (seperti dalam senyawa air, H2O), nitrogen (N) dengan valensi 3 (seperti dalam amonia, NH3), dan klorin (Cl) dalam valensi 1 (seperti pada hidrogen klorida, HCl). Meskipun konsep valensi sangat merujuk pada sifat intrinsik atom, ada beberapa aspek yang membingungkan, seperti pengamatan bahwa beberapa elemen tampaknya memiliki lebih dari satu valensi umum. Elemen karbon misalnya ditemukan memiliki valensi khas 2 dan 4.
Diagram Lewis
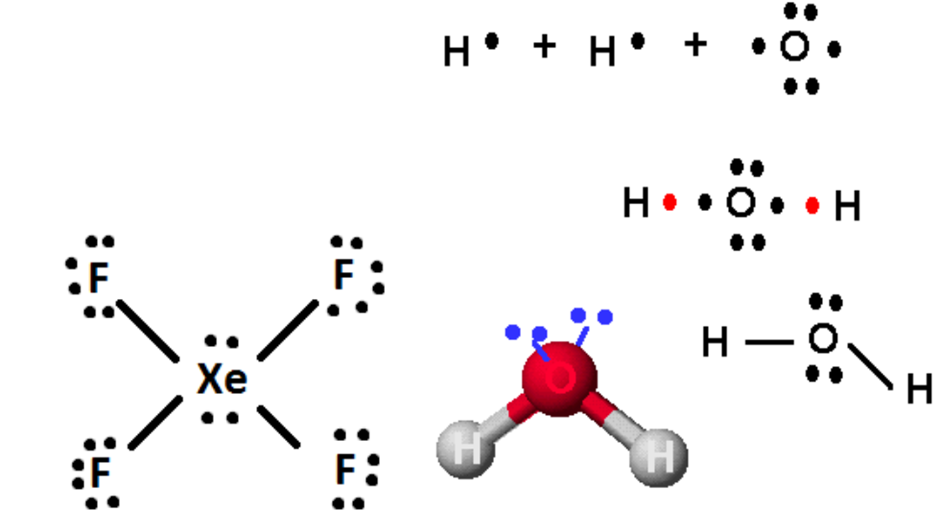
Diagram Lewis merupakan representasi grafis dari unsur-unsur dan elektron valensinya. Elektron valensi merupakan elektron yang membentuk kulit terluar suatu atom. Pada diagram Lewis, suatu unsur ditulis ditengah dan elektron valensinya digambarkan di sekelilingnya sebagai titik. Posisi elektron valensi umumnya secara konvensi dimulai dari posisi jam 12 dan bergerak searah jarum jam ke posisi jam 3, jam 6, dan jam 9, lalu kembali ke posisi jam 12. Umumnya angka romawi kelompok sesuai dengan jumlah elektron yang mengelilingi unsur tersebut. Tabel periodik unsur merupakan representasi dari jumlah elektron valensi. Logam alkali misalnya berada pada golongan IA karena memiliki satu elektron terluar, logam alkali tanah golongan IIA karena memiliki 2 elektron terluar, demikian seterusnya.
Diagram Lewis untuk senyawa atau ion molekul
Untuk menggambar diagram Lewis pada senyawa atau ion molekul, dapat mengikuti langkah-langkah dibawah ini. Pada contoh dibawah ini, H2O digunakan sebagai contoh.
- Hitung jumlah elektron valensi molekul senyawa atau ion. Jika ada dua atau lebih unsur yang sama, maka kita harus menggandakan atau mengalikannya dengan jumlah elektron valensi, terelepas dari berapapun jumlah atomnya. Ikuti penulisan angka romawi untuk melihat jumlah elektron valensi dari unsur tersebut.
- Elektron Valensi:
- Oksigen (O)–Grup VIA: oleh karena itu, ada 6 elektron valensi
- Hidrogen (H)–Grup IA: oleh karena itu, ada 1 elektron valensi
- CATATAN: Ada DUA atom hidrogen, jadi kalikan 1 elektron valensi X 2 atom
- Jumlah: 6 + 2 = 8 elektron valensi
- Elektron Valensi:
- Jika molekul yang dimaksud adalah ion, ingatlah untuk menjumlahkan atau mengurangi jumlah elektron masing-masing dengan jumlah total dari langkah 1. Untuk ion, jika ion memiliki muatan negatif (anion), tambahkan jumlah elektron yang sesuai ke jumlah total elektron (Misalnya jika NO3– memiliki muatan negatif -1, maka kita harus menambahkan 1 elektron tambahan ke elektron total, sehingga 5+3(6) = 23+1 = 24 elektron total. Tanda pangkat minus (–) berarti molekul memiliki muatan negatif sehingga harus ada elektron yang ditambahkan. Hal ini karena anion memiliki afinitas elektron yang lebih tinggi. Sebagian besar anion terdiri dari non logam yang memiliki eletronegativitas yang tinggi.
- Jika ion memiliki muatan positif (kation), kurangi jumlah elektron yang sesuai dengan jumlah total elektron (misalnya H3O+ memiliki muatan positif 1+, sehingga kita harus mengurangi 1 elektron tambahan dengan total 6+1(3)=9-1=8 elektron total. Tanda (+) berarti molekul memiliki muatan positif secara keseluruhan sehingga harus kehilangan satu elektron. Kation positif dan memiliki memiliki afinitas elektron yang lebih lemah dimandingkan anion. Sebagian besar terdiri dari logam. Dengan ini berarti elektron terluar meningkat sehingga elektron memiliki kecenderungan untuk lebih sedikit tertarik ke inti unsur. Oleh karena air adalah molekul netral, tidak ada elektron yang perlu ditambahkan atau dikurangi dari jumlah elektron total.
- Tuliskan simbol elemen, pastikan semua atom telah dihitung (misalnya H2O, tuliskan O dan 2 elektron di kedua sisi oksigen). Mulailah dengan menambahkan ikatan tunggal (1 pasang elektron) ke semua atom yang memungkinkan sambil memastikan bahwa unsur mengikuti aturan oktet.
- Jika ada elektron tersisa, maka tambahkan ke atom pusat molekul (Contohnya XeF4 memiliki 4 elektron tambahan setelah didistribusikan, sehingga 4 elektron tambahan diberikan pada X2). Akhirnya pengaturan ulang pasangan elektron menjadi ikatan ganda atau tiga jika memungkinkan.
Aturan Oktet
Sebagian besar elemen mengikuti aturan oktet dalam ikatan kimia, yang berarti bahwa suatu elemen harus memiliki kontak dengan delapan elektron valensi dalam ikatan atau dengan tepat mengisi cangkang valensi. Memiliki total delapan elektron memastikan bahwa atom stabil. Inilah alasan mengapa gas mulia, kulit elektron valensi 8 elektron, secara kimiawi inert; mereka sudah stabil dan cenderung tidak membutuhkan transfer elektron saat berikatan dengan atom lain agar stabil. Di sisi lain, logam alkali memiliki kulit elektron valensi satu elektron. Karena logam alkali mengikuti aturan oktet, maka cenderung kehilangan satu elektron. Hal ini menyebabkan logam alkali cukup reaktif karena dapat dengan mudah menyumbangkan elektron ke unsur lain. Hal ini menjelaskan sifat yang sangat reaktif dari group IA. Beberapa elemen yang merupakan pengecualian untuk aturan oktet adalah aluminium (Al), fosfor (P), Surfur (S), dan Xenon (Xe). Hidrogen (H) dan helium (He) masih mengikuti aturan oktet karena valensi terluarnya terdiri dari dua elektron. Tidak ada pengecualian dalam aturan ini sehingga hidrogen dan helium akan selalu memiliki maksimal dua elektron.
Ikatan Ionik
Ikatan ionik adalah proses dimana tidak terjadi berbagi elektron antara dua atom. Hal ini terjadi antara non-logam dan logam. Ikatan ionik juga dikenal sebagai proses dimana elektron ditransfer dari satu atom ke atom lainnya yang memiliki tingkat efinitas elektron yang berbeda. Contohnya adalah pada ion natrium (Na) dan klorin (Cl) yang digambungkan dalam ikatan ionik. Na+ memiliki lebih sedikit elektronegativitas karena radius atom yang besar dan pada dasarnya tidak menginginkan eletron yang lainnya. Hal ini akan menyebabkan kemungkinan atom klorin yang lebih eletronegatif untuk mendapatkan elektron. Sepanjang proses ini, transfer elektron melepaskan energi ke atmosfer.
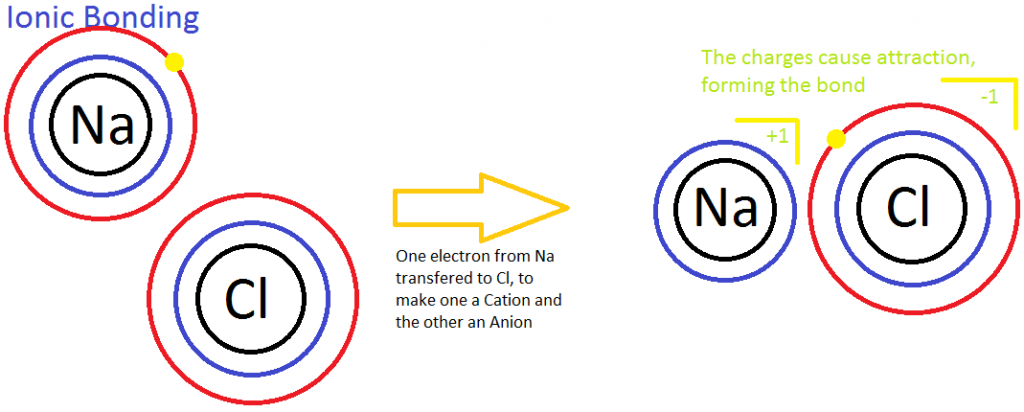
Contoh lainnya dari ikatan ionik adalah struktur kristal yang terbentuk. Ion diatur sedemikian rupa sehingga menunjukkan uniformity dan stability (karakteristik fisik dalam kristal dan padatan). Selain itu, struktur molekul logam terdiri dari ion positif yang stabil (kation) dan elektron bebas yang terdapat diantara kation. Elektron yang mengalir memungkinkan arus listrik untuk melewatinya. Selain itu, hal ini menjelaskan mengapa elektrolit kuat adalah konduktor yang baik. Ikatan ionik mudah putus oleh air karena polaritas molekul air melindungi anion dari menarik kation. Oleh karena itu, senyawa ionik terdisosiasi dengan mudan dalam air dan sifat logam senyawa memungkinkan terjadinya konduktivitas larutan.
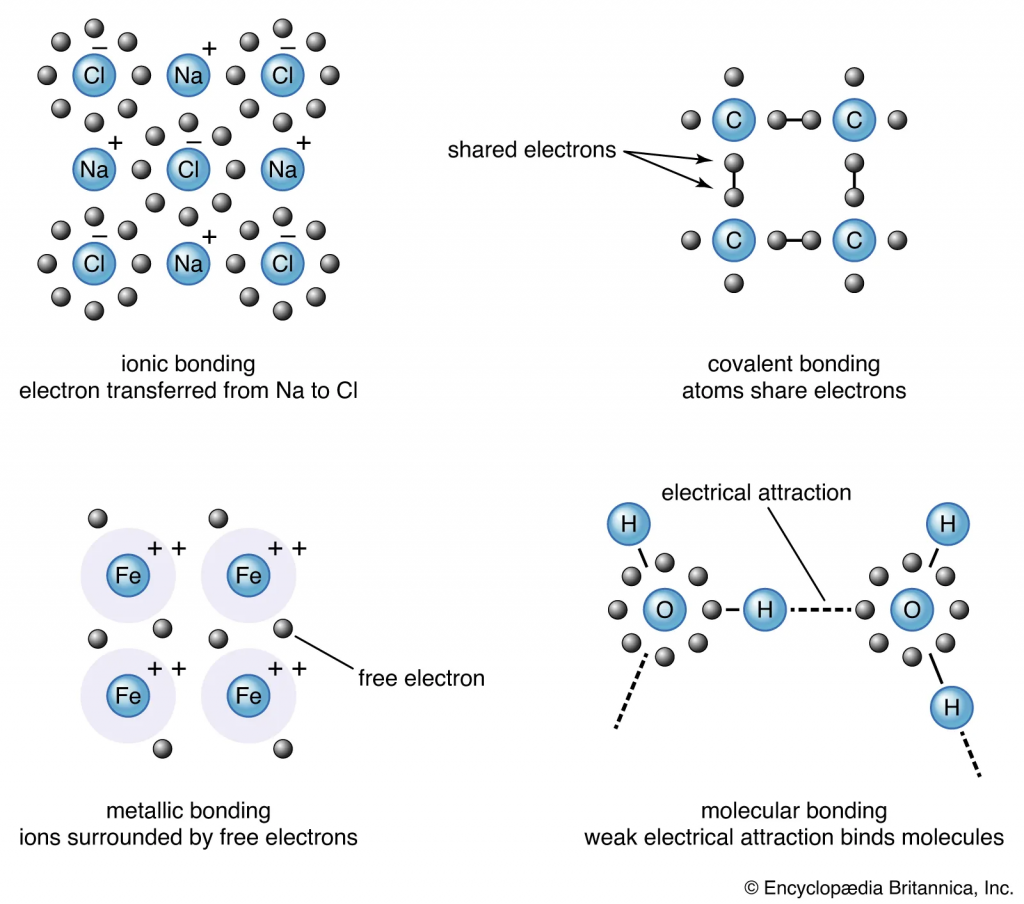
Ikatan Kovalen
Ikatan kovalen merupakan proses berbagi elektron antara dua atom. Ikatan biasanya terjadi antara non-logan dengan non-logam. Karena ke elektronegatifannya yang dalam kisaran tinggi, elektron tertarik dan ditarik oleh inti kedua atom. Dalam kasus dua atom identifk yang terikat satu sama lain (dikenal dengan ikatan non-polar), keduanya memancarkan gaya tarik menarik yang sama pada elektron, sehingga ada daya tarik yang sama antara dua atom (yaitu oksigen gas, atau O2, memiliki distribusi afinitas elektron yang sama, sehingga ikatan kovalen lebih sulit untuk diputuskan).
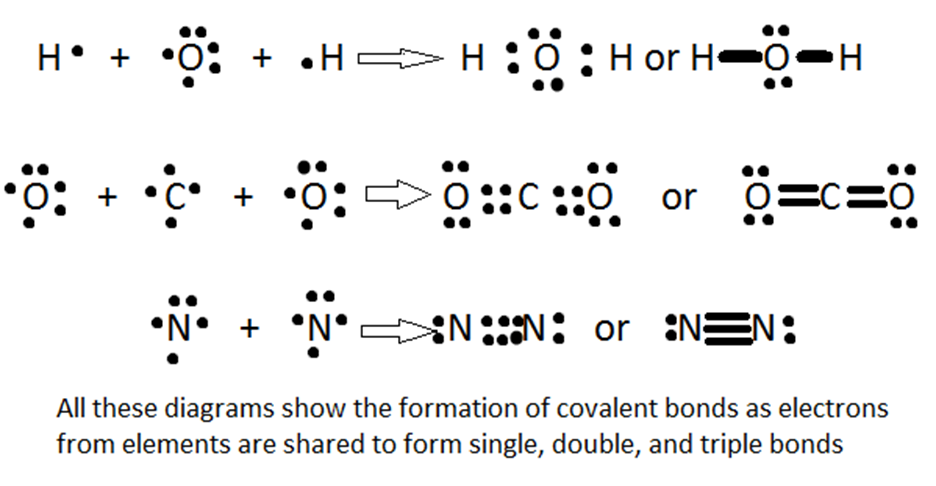
Terdapat tiga jenis ikatan kovalen yaitu ikatan tunggal, rangkap dua, dan rangkap tiga. Ikatan tunggal terdiri dari 2 elektron terikat. Secara alami, ikatan rangkap memiliki 4 elektron, dan ikatan rangkap tiga memiliki 6 elektron. Karena ikatan rangkap tiga akan memiliki kekuatan afinitas elektron yang lebih besar daripada ikatan tunggal, gaya tarik ke inti bermuatan positif akan meningkat. Artinya jarak dari intik ke elektron lebih kecil. Sederhananya, semakin banyak iaktan atau semakin besar kekuatan ikatan, semakin pendek panjang ikatan. Dengan kata lain ikatan rangkap tiga memiliki panjang ikatan yang lebih pendek dibanding ikatan tunggal.
Ikatan Kovalen Polar
Ikatan kovalen polar adalah proses pembagian elektro yang tidak seimbang. Hal ini dianggap sebagai jalan tengah antara ikatan ion dengan ikatan kovalen. Hal ini terjadi karena terdapat perbedaan nilai keelektronegatifan dua atom tersebut. Karena itu, atom yang lebih elektronegatif akan menarik dan memiliki gaya tarik yang kuat pada elektron. Dengan demikian, elektron akan menghabiskan lebih banyak waktu di sekitar atom ini. Simbol dibawah menunjukkan bahwa pada sisi fourine memiliki sisi negatif dan sisi hidrogen memiliki sisi positif.
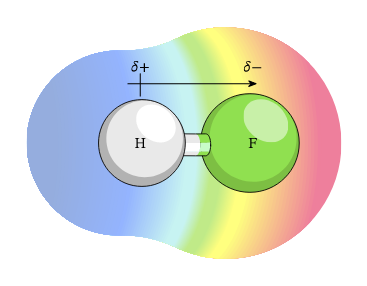
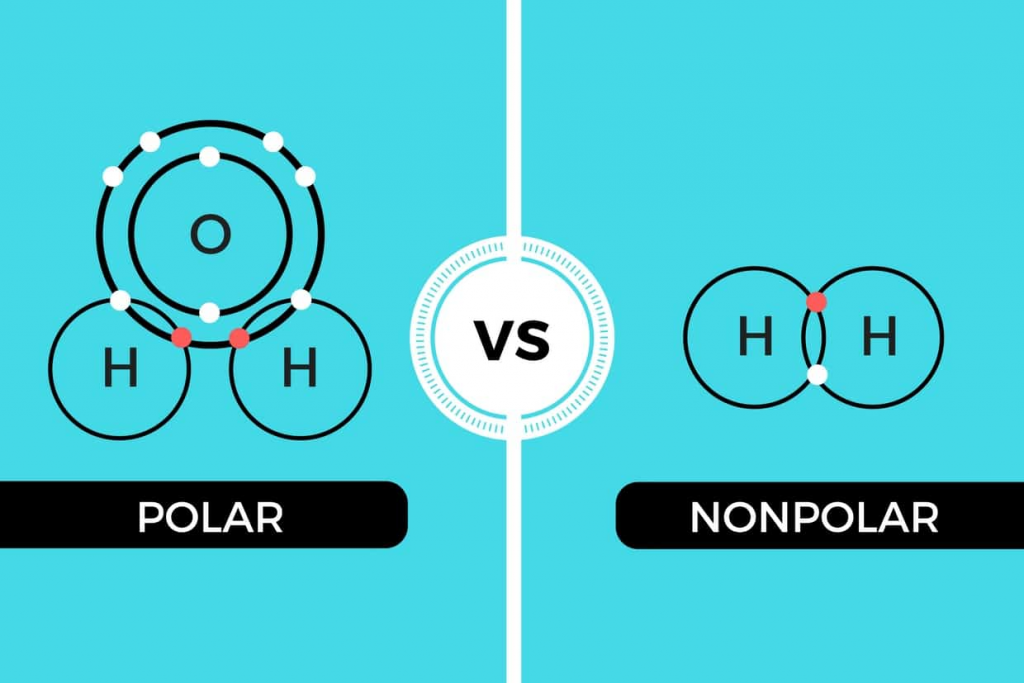
Molekul Polar dan Non-Polar
Polaritas adalah gaya tarik menarik antara dua atom untuk elektron. Hal ini juga dikenal dengan istilah ikatan kovalen polar. Suatu molekul bersifat polar ketika elektron tertarik ke atom yang memiliki nilai elektronegatif yang lebih tinggi karena afinitas elektronnya yang lebih besar. Molekul non-polar merupakan ikatan antara dua atom yang identik. Contohnya adalah gas nitrogen (N2), oksigen (O2), dan hidrogen (H2). Salah satu cara untuk mengetahui ikatan yang dimiliki suatu molekul adalah dengan menentukan perbedaan nilai keelektronegatifan molekulnya. Jika perbedaannya antara 0,00 – 0,3, maka molekul tersebut cendrung memiliki ikatan non-polar. Jika berada antara 0,3 – 1,7, maka molekul tersebut memiliki ikatan polar, sedangkan jika perbedaannya lebih dari 1,7, maka molekul tersebut memiliki ikatan ion.