Interaksi Molekul
Apa Yang Dimaksud Interaksi Molekul?
Interaksi Molekul. Interaksi molekul adalah gaya tarik menarik atau tolak menolak antar molekul dan antar atom yang tidak terikat. Interaksi molekul penting dalam semua aspek kimia, biokimia, dan biofisika, termasuk pelipatan protein, desain obat, deteksi patogen, ilmu material, sensor, nanoteknologi, pemisahan, dan asal usul kehidupan. Interaksi molekul juga dikenal sebagai interaksi nonkovalen, interaksi antarmolekul, interaksi non-ikatan, gaya nonkovalen, dan gaya antarmolekul. Kelima frasa ini memiliki arti yang sama.
Interaksi Non-Ikatan. Interaksi Molekuler adalah interaksi antar molekul, atau antar atom yang tidak terikat oleh ikatan. Interaksi molekuler meliputi gaya kohesif (tarik antara yang sejenis), adhesif (tarikan antara yang tidak sejenis) dan gaya tolak menolak antar molekul. Interaksi molekul berubah (dan ikatan tetap utuh) ketika (a) es mencair, (b) air mendidih, (c) karbon dioksida menyublin, (d) protein unfold, (e) RNA unfold, (f) untai DNA terpisah dan (g) membran terbuka.
Gambar 1. Bentuk-bentuk interaksi molekuler di dalam tubuh
Interaksi ikatan. Ikatan mengikat atom-atom dalam molekul. Molekul adalah sekelompok atom yang berasosiasi cukup kuat sehingga tidak terdisosiasi atau kehilangan struktur ketika berinteraksi dengan lingkungannya. Pada suhu kamar dua atom nitrogen dapat terikat (N2). Ikatan dapat putus dan terbentuk kembali selama reaksi kimia. Dalam reaksi kimia, ikatan selulosa putus, sementara ikatan karbon dioksida dan air terbentuk.
Titik didih. Ketika sebuah molekul bertransisi dari fase cair ke fase gas (seperti selama perebusan), idealnya semua interaksi molekuler terganggu. Perbedaan suhu didih memberikan indikasi kualitatif yang baik dari kekuatan interaksi molekuler dalam fase cair. Cairan dengan titik didih tinggi memiliki interaksi molekul yang kuat. Titik didih H2O ratusan derajat lebih besar dari titik didih N2 karena interaksi molekul yang lebih kuat di H2O (liq) daripada di N2 (liq). Gaya antar molekul di H2O (liq) lebih besar daripada di N2 (liq).
Pelipatan dan Perakitan Makromolekul Biologis
Dalam sistem biologi, makromolekul sering terbentuk karena adanya lipatan dan perakitan dari monomernya. Contohnya adalah protein yang terlipat membentuk struktur globular, ribosom dan RNA transfer yang juga terlipat membentuk struktur tiga dimensi, DNA rantai tunggal yang membentuk DNA rantai ganda, fosfolipid merupakan ikatan antara lipid dan fosfor yang terdapat pada bilayer pembentuk membran , serta struktur lainnya dari makromolekul yang terdapat di dalam sel. Pelipatan dan perakitan ini distabilkan oleh adanya interaksi molekuler baik dalam jumlah maupun kompleksitasnya yang sangat besar. Ketika protein, DNA, atau RNA terdenaturasi, maka ikatan kimia antar senyawa dalam makromolekul sebelumnya akan terputus dan digantikan dengan ikatan kimia dengan lingkungan barunya. Interaksi molekuler umumnya didorong karena adanya perbedaan muatan listrik pada kedua senyawa yang berikatan. Interaksi molekuler menstabilkan keadaan lipatan dan rakitan yang telah dibentuk. Sejumlah besar rinteraksi intramolekul akan rusak akibat gangguan kecil yang dapat mengubah keseimbangan dari keadaan terlipat ke keadaan tidak terlipat. Perubahan kecil tersebut dapat berbentuk pH atau suhu. Contohnya adalah ketika kita memanaskan telur hingga suhu 60 derajat celcius, protein albumin akan terdenaturasi. Kita tidak merusak ikatan antar protein pada saat merebus telur, tetapi kita mengubah dan mengatur ulang interaksi molekuler dalam protein tersebut, sehingga tampilan telur menjadi berwarna putih. Saat kita menambahkan jus lemon ke dalam susu, pH akan turun dan protein pada susu akan terdenaturasi. Untuk proses denaturasi DNA, dapat dicontohkan pada proses reaksi PCR (Polymerase Chain Reaction).
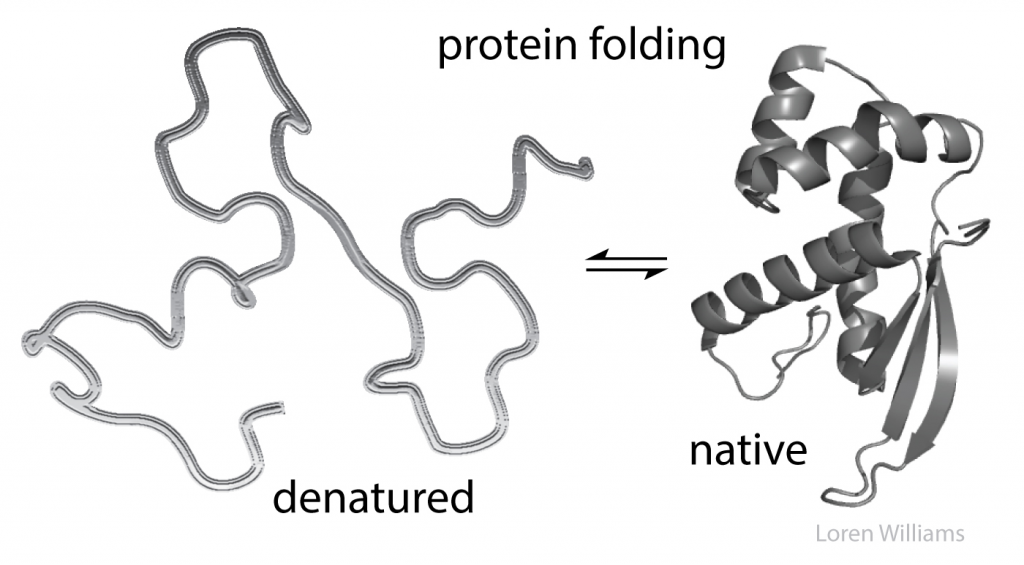
Gambar 2. Bentuk protein folding yang terdenaturasi
Catatan Terkait Nomenklatur
Interaksi molekuler ditemukan ilmuwan asal Belanda, Johannes Diderik van Der Waals. Waals mengamati bahwa molekul memiliki ruang dan berikatan antara molekul satu dengan yang lainnya. Interaksi molekuler juga dikenal sebagai interaksi non-kovalen atau antar molekul, atau non-ikatan. IUPAC menawarkan beberapa definisi terkait hal ini seperti “van der Waals interaction”, salah satunya. Istilah ‘Van der Waals Surface’ dan ‘Van der Waals Radius’ terdefenisi dengan baik dan memiliki manfaat. Semua interaksi molekuler pada dasarkan bersifat elektrostatik. Namun istilah interaksi elektrostatik digunakan untuk menggambarkan interaksi antara spesies yang dibebankan atas ion yang dimiliki spesies tersebut. Ada banyak cara penguraian dan pengklasifikasian interaksi molekuler. Kategori dalam gam
Interaksi Elektrostatik
Interaksi elektrostatik adalah interaksi si antara kation dan anion di mana kedua unsur atau senyawa memiliki muatan yang yang berbeda. Interaksi elektrostatik dapat menarik atau menolak, tergantung pada muatan dari senyawa atau molekulnya. Keuntungan dari interaksi elektrostatik yaitu menyebabkan adanya tekanan uap pada natrium klorida dan garam lainnya menjadi sangat rendah. Interaksi elektrostatik dalam kristal natrium klorida disebut dengan ikatan ionik. Tetapi jika kation dalam bentuk tunggal dan anion dalam bentuk tunggal berdekatan, contohnya dalam protein atau lipatan RNA, interaksi tersebut dianggap sebagai interaksi elektrostatik non kovalen. Interaksi elektrostatik non kovalen bisa sangat kuat dan dan menjalankan aksi dari jarak yang jauh. Interaksi elektrostatik adalah Interaksi yang menstabilkan fosfat oksigen pada RNA dan dan ion magnesium. Ada banyak ion magnesium yang terkait dengan DNA atau RNA di dalam sel. Interaksi elektrostatik dapat dilemahkan oleh air. Interaksi elektrostatik sangat bergantung pada konsentrasi garam dan PH pada lipatan protein DNA dan RNA. Interaksi elektrostatik antara anion dan kation pada ikatan antar asam amino sering terjadi pada tingkat protein. Kelompok-kelompok bermuatan dalam pasangan ion umumnya dihubungkan dengan ikatan hidrogen selain adanya interaksi elektrostatik.
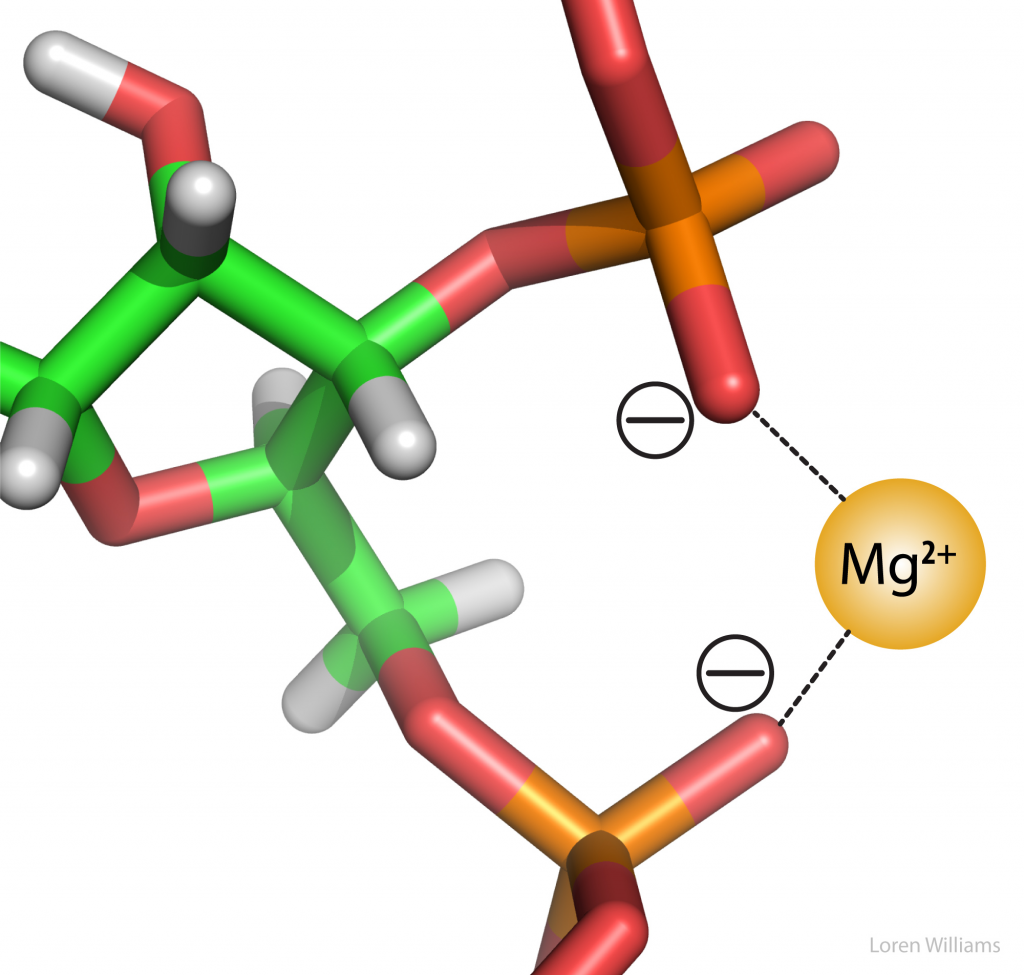
Gambar 3. Interaksi Elektrostatik pada pada RNA dimana terjadi ikatan antara anion phospate oksigen yang diikat dengan magnesium kation. Dua gugus fosfat dapat berikatan dalam ion magnesium.
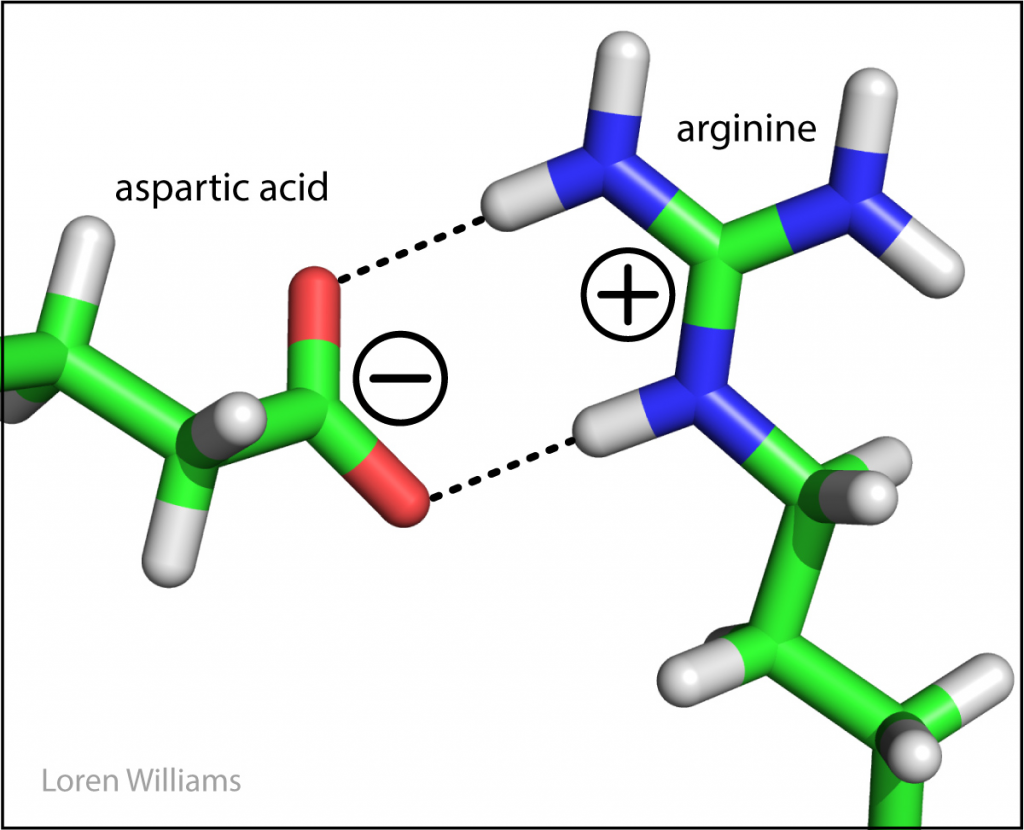
Gambar 4. Ikatan ion yang terjadi pada folding protein. Asam amino asam aspartic anion diikatkan dengan interaksi eletrostatik dengan arginine kation.
Interaksi Dipolar
Elektronegativitas dan dipol molekuler
Sebelum kita dapat memahami interaksi dipolar, kita harus tahu tentang elektronegativitas. Elektron tidak dibagi secara merata pada molekul dengan atom yang tidak mirip. Kencenderungan atau apapun itu untuk menarik elektron ke arah dirinya sendiri dan menjauh dari atom lainnya nya yang ditandai dengan kuantitas disebut dengan elektronegativitas. Fluor adalah atom yang paling elektronegativitas dan cesium adalah wah wah atom yang paling tidak elektronegatif. Secara umum elektronegativitas meningkat seiring dengan meningkatnya muatan inti. Elektronegativitas meningkat ketika pelindung dari inti menurun. Dalam suatu molekul yang terdiri dari atom dengan berbagai elektronegativitas, atom dengan elektronegativitas terendah memilikimuatan positif parsial dan atom dengan elektronegativitas terbesar memiliki muatan parsial negatif. Perbedaan dalam elektronegativitas dari dua atom yang saling berikatan menyebabkan ikatan di antara mereka menjadi lebih polar dan muatan parsial pada atom menjadi lebih besar. Dalam sistem biologis, oksigen merupakan atom paling elektronegatif bawa muatan parsial negatif paling besar. Dalam metanol (CH3OH), elektronegatif atom oksigen menarik elektron dari atom karbon dan hidrogen. Dalam air, elektronegatif atom oksigen menarik elektron dari kedua atom hidrogen. Atom oksigen air membawa muatan negatif parsial. Atom hidrogen membawa muatan positif parsial. Fenomena pemisahan muatan ini yang disebut dengan polaritas. Metanol dan air adalah molekul polar. N2 merupakan molekul non-polar karena dua atom nitrogen memiliki tingkat eletronegativitas yang sama sehingga keduanya berbagi elektron yang sama.
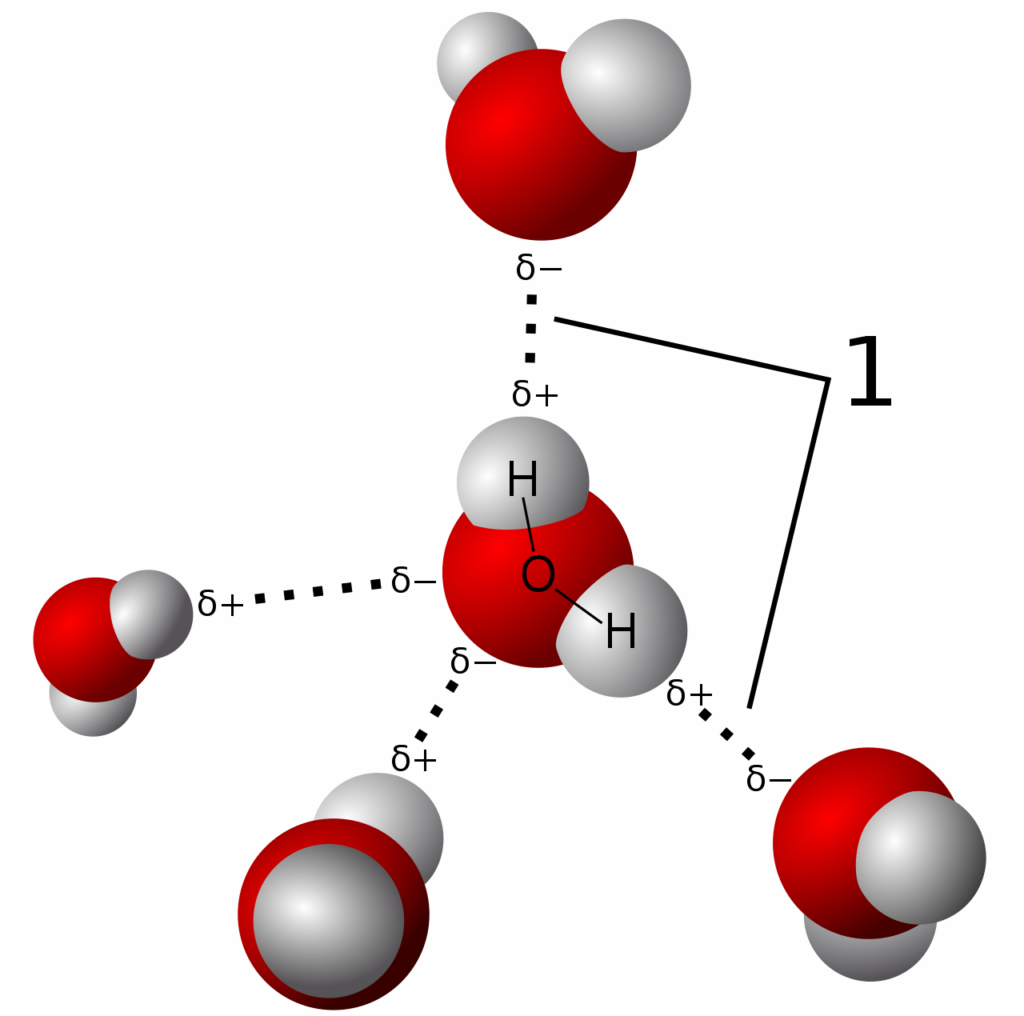
Gambar 5. Muatan parsial dan dipol molekul air. Atom oksigen elektronegatif menarik elektrond ari atom hidrogen. Oksigen membawa muatan negatif parsial dan atom hidrogen membawa muatan positif parsial.
Interaksi Dipolar-dipolar
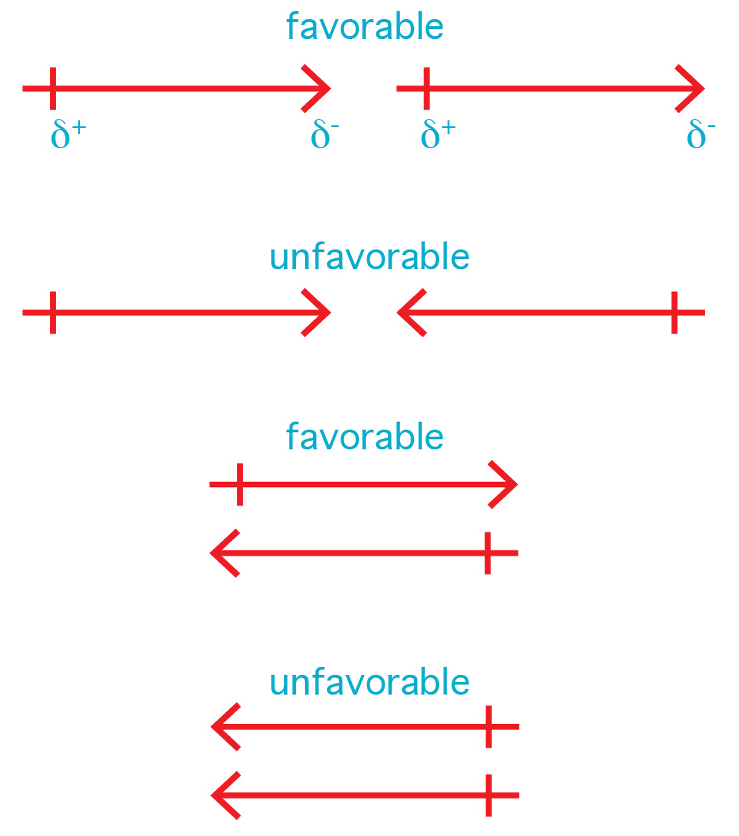
Dua dipol saling merasakan antara satu dengan yang lainnya meskipun berada pada jarak yang jauh. Ujung positif dari dipol pertama tertarik pada ujung negatif dari dipol kedua dan saling tolak-menolak pada kutub yang sama. Kekuatan interaksi dipol-dipol sangat bergantung pada ukuran kedua dipol, kedekatan, serta orientasinya. Energi interaksi antara dua dipol dapat bermuatan positif maupun negatif.
Interaksi Pengisian Dipolar
Molekul dengan dipol permanen dapat berinteraksi dengan kation dan anion. Jenis interaksi ini disebut interaksi pengisian daya atau interaksi ion-dipol. Interaksi pengisian daya adalah mengapa natrium klorida, ion natrium kationik yang disusun dan ion anionik klorida, dan garam lainnya cenderung berinteraksi dengan baik dengan air, dan sangat larut dalam air, yang memiliki dipol yang kuat.
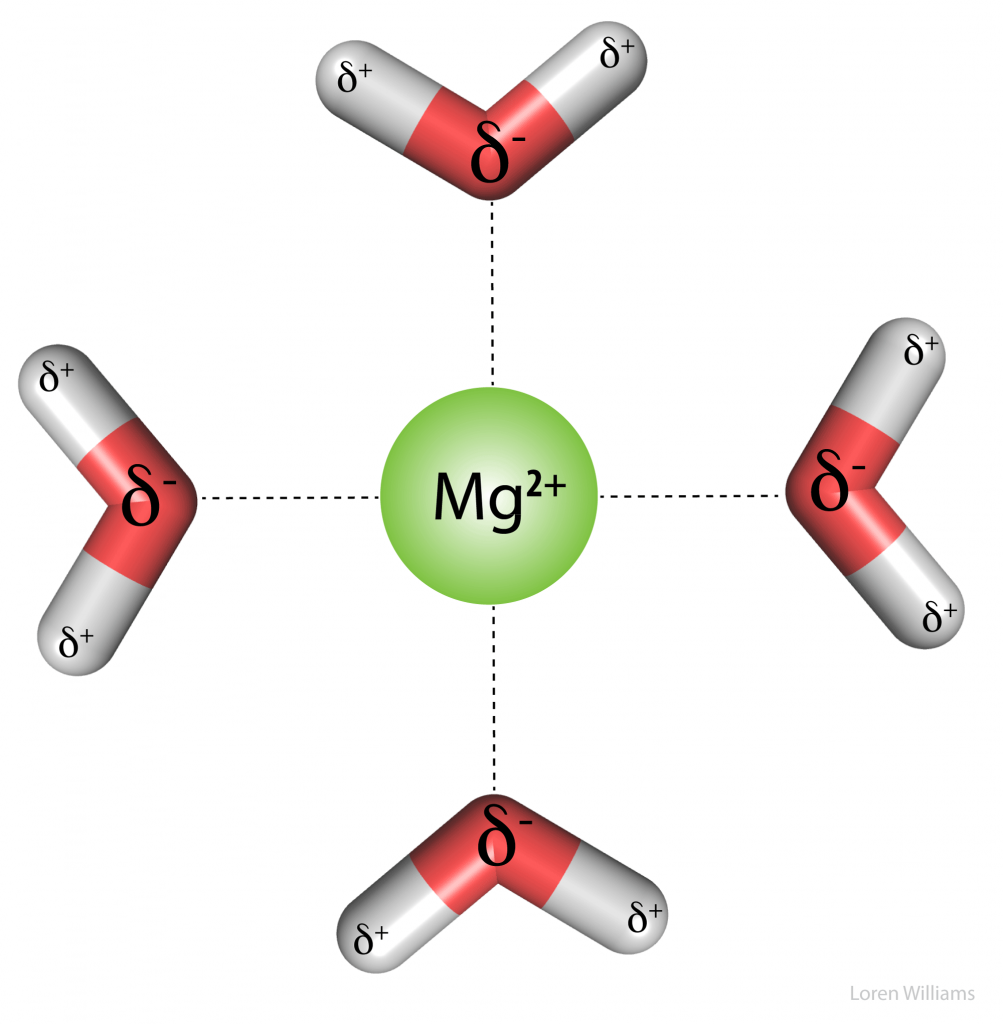
Gambar 6. Interaksi pengisian daya. Empat molekul air diperlihatkan berinteraksi dengan baik dengan dication magnesium. Ujung negatif dari dipol air diarahkan ke ion magnesium bermuatan positif. Enam molekul air mengoordinasikan magnesium dalam larutan. Dua dihilangkan untuk kejelasan. Untuk anion seperti klorida, molekul air mengalihkan arah dan mengarahkan ujung positif dari dipolnya ke arah anion. Di sini garis putus -putus tidak mewakili ikatan hidrogen. Tidak ada atom hidrogen antara kation Mg2+ dan atom oksigen air.
Interaksi dipolar yang berfluktuasi
Elektron, bahkan dalam atom berbentuk bola seperti helium atau xenon, berfluktuasi dari waktu ke waktu sesuai dengan frekuensi resonansi alami atom itu. Meskipun ahli kimia menggambarkan atom seperti helium dan xenon sebagai bentuk bola, jika kita bisa mengambil snapshot instan dari atom berbentuk bola, kita akan selalu menangkapnya dalam keadaan non-bola sementara. Xenon rata-rata berbentuk bulat, tetapi tidak pada titik waktu tertentu. Saat kepadatan elektron berfluktuasi, momen dipol juga berfluktuasi. Oleh karena itu, semua molekul dan atom yang mengandung dipol berosilasi. Semua molekul yang berdekatan (dalam cairan atau padatan apa pun, tetapi tidak dalam gas) dengan dipol yang berosilasi saling merasakan dan berpasangan. Molekul berosilasi dalam sinkronisasi. Pergerakan elektron dalam molekul yang berdekatan berkorelasi. Elektron dalam satu molekul cenderung melepaskan diri dari yang berikutnya, karena tolakan elektrostatik. Dipol yang berfluktuasi digabungkan mengalami interaksi elektrostatik yang menguntungkan yang dikenal sebagai interaksi dispersif.
Interaksi dispersif selalu menarik dan terjadi antara setiap molekul (atau atom non-ikatan), polar atau non-polar, yang ada di dekatnya satu sama lain. Interaksi dispersif meningkat dengan polarisasi, yang menjelaskan tren peningkatan titik didih (misalnya Meningkatkan kekuatan interaksi dispersif) dalam seri He (BP 4,5K), Ne (27P), Ar (87K), Kr (120K) dan Ze (165K). Interaksi dispersif adalah satu-satunya kekuatan menarik antara atom dalam cairan ini. Tanpa interaksi dispersif tidak akan ada keadaan likuid dari molekul tersebut. Jumlah total interaksi dispersif atom-atom berpasangan dalam protein terlipat sangat besar, sehingga interaksi dispersif dapat memberikan kontribusi besar terhadap stabilitas. Kekuatan interaksi ini terkait dengan polarizabilitas. Tryptophan, tirosin, fenilalanin, dan histidin adalah rantai asam amino yang paling terpolarisasi, dan membentuk interaksi pengipuan terkuat dalam protein. Bahkan molekul dengan dipol permanen, seperti air, mengalami interaksi dispersif. Sekitar 25% dari kekuatan menarik antara molekul air dalam cairan bersifat dispersif.
Ikatan Hidrogen
Gagasan bahwa atom hidrogen tunggal dapat berinteraksi secara bersamaan dengan dua atom lain telah diusulkan pada tahun 1920 oleh Latimer dan RodeBush serta penasihat mereka, G. N. Lewis. Maurice Huggins, yang juga seorang mahasiswa di laboratorium Lewis, menggambarkan ikatan hidrogen dalam disertasinya pada tahun 1919. Ikatan hidrogen adalah interaksi yang saling menguntungkan antara atom dengan sepasang elektron tunggal (Basis Lewis) dan atom hidrogen yang sebagian diambil elektronnya karena secara kovalen terikat pada atom elektronegatif (N, O, atau S ). Dalam ikatan hidrogen, basis Lewis adalah akseptor ikatan hidrogen (A) dan proton yang terpapar sebagian terikat pada donor ikatan hidrogen (H-D).
Mengapa Hidrogen? Hidrogen adalah atom khusus karena merupakan satu-satunya atom yang membentuk ikatan sigma kovalen dengan atom elektronegatif seperti N, O dan S, dan menggunakan elektron valensi (1S) dalam ikatan kovalen tersebut. Ketika atom lain dalam ikatan elektronegatifnya menarik elektron dari hidrogen, nukleus hidrogen (proton) terpapar di sisi belakang (distal dari mitra ikatan). Permukaan proton yang tidak terlindung terpapar, menarik muatan negatif parsial dari pasangan elektron sendirian. Hidrogen adalah satu-satunya atom yang memaparkan nukleusnya dengan cara ini. Atom-atom lain memiliki elektron non-ikatan valensi bagian dalam yang melindungi nukleus.
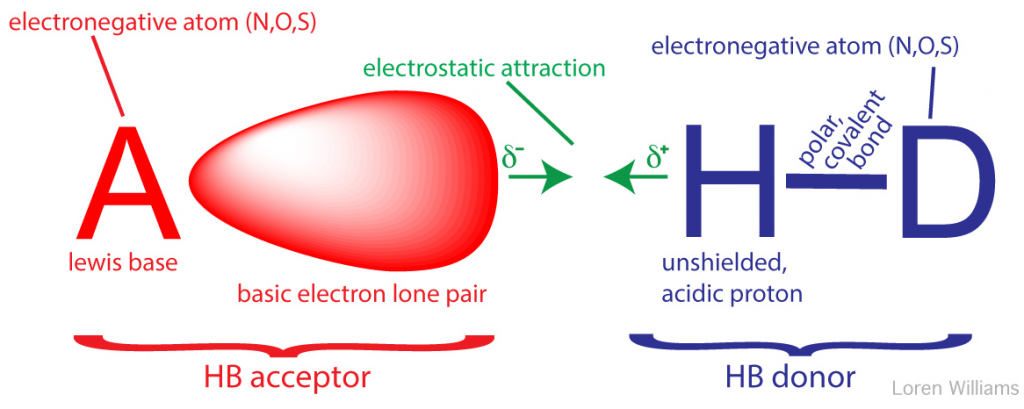
Gambar 7. Ilustrasi element ikatan hidrogen, mencakup HB akseptor dan HB donor pasangan tunggal dan proton yang terbuka. N, O, dan S adalah atom ikatan hidrogen dominan (A&D) dalam sistem biologis.
Ikatan hidrogen bukanlah reaksi asam-basa, di mana proton (H+) sepenuhnya ditransfer dari H-D ke A untuk membentuk D- dan HA+. Namun, kekuatan ikatan hidrogen berkorelasi dengan baik dengan keasaman donor H-D dan kebaikan akseptor A. Dalam ikatan hidrogen, H+ sebagian ditransfer dari H-D ke A, tetapi H+ tetap secara kovalen melekat pada D. Ikatan H-D tetap ada utuh. Ikatan hidrogen yang paling umum dalam sistem biologis melibatkan atom oksigen dan nitrogen sebagai gugus A dan D. Keto (= O), amina (R3N), imin (r = N-R) dan gugus hidroksil (-OH) adalah akseptor ikatan hidrogen yang paling umum Dalam DNA, RNA, protein dan karbohidrat kompleks. Gugus hidroksil dan amina/imina adalah donor ikatan hidrogen yang paling umum. Hidroksil dan amina/imina dapat menyumbangkan dan menerima ikatan hidrogen.
Dalam sistem biologis, ikatan hidrogen sering kali kooperatif dan distabilkan dengan resonansi yang melibatkan beberapa ikatan hidrogen. Dalam sistem dengan beberapa ikatan hidrogen, kekuatan satu ikatan hidrogen meningkat dengan ikatan hidrogen yang berdekatan. Sebagai contoh dalam sistem yang terikat hidrogen di bawah ini (dimer asam asetat), ikatan hidrogen atas meningkatkan keasaman hidrogen, dan basa-basi oksigen dalam ikatan hidrogen bawah. Setiap ikatan hidrogen membuat yang lain lebih kuat dari pada isolasi. Koperasi ikatan hidrogen diamati pada pasangan basa dan dalam protein terlipat.
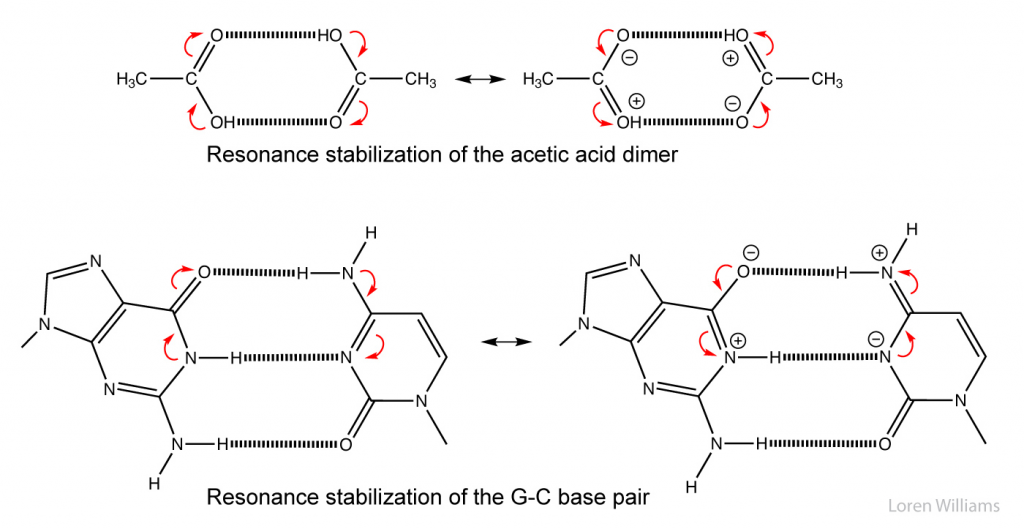
Gambar 8. Kooperativitas ikatan hidrogen dari dimer asam asetat. Satu ikatan hidrogen meningkatkan stabilitas ikatan hidrogen yang berdekatan. Demikian pula sebaliknya.
Air: Cairan Kehidiupan
Air merupakan senyawa yang paling berlimpah di permukaan bumi dan mungkin juga di alam semesta serta menjadi media yang universal bagi komponen biologis. Air juga merupakan senyawa kimia yang paling sering digunakan dalam biokimia. Lebih dari setengah dari seluruh proses reaksi biokimia yang diketahui melibatkan konsumsi maupun produksi senyawa air. Di dalam sel, molekul air yang yang ada sering dan berulang kali berfungsi sebagai substrat reaksi, perantara, kofaktor, dan produk. Air merupakan metabolit yang paling melimpah dan universal serta menyumbang lebih dari 99% metabolit dalam bakteri E. coli. Pada dasarnya seluruh molekul biologi, baik yang berukuran besar maupun yang berukuran kecil, merupakan produk atau substrak untuk reaksi biokimia yang secara kimiawi melibatkan air. Air tidak pernah absen secara fisik dari makromolekul biologis. Dalam sistem biologis, air sepenuhnya terdegradasi ke dalam proses pembuatan ikatan dan pemecahan ikatan kimia.
Penggunaan air sebagai metabolit terlihat dalam pembentukan biopolimer. Semua biopolimer dibentuk oleh reaksi dehidrasi kondensasi, yang menghubungkan blok bangunan kecil dan secara kimia menghasilkan air (ditunjukkan di sini). Secara khusus, ikatan peptida dalam protein dibentuk oleh kondensasi asam amino. Dalam reaksi bersih, dua asam amino bergabung bersama dan menghasilkan satu molekul air untuk membentuk ikatan peptida. Air adalah produk dalam reaksi kimia pembentukan ikatan peptida. Dalam reaksi terbalik, biopolimer terdegradasi oleh reaksi hidrolisis, yang secara kimia mengkonsumsi air. Air adalah reaktan dalam reaksi kimia pemecahan ikatan peptida. Polinukleotida (DNA dan RNA) dibentuk oleh kondensasi nukleotida (DG, DT, DA, DC untuk DNA), yang pada gilirannya dibentuk oleh kondensasi substruktur yang lebih kecil. Trigliserida dan fosfolipid dibentuk oleh kondensasi gliserol dengan asam lemak dan molekul lainnya. Selulosa, polimer paling melimpah dalam biosfer, dibentuk oleh kondensasi glukosa.