Plasenta dan Membran Ekstra Embrionik
Salah satu ciri paling khas dari perkembangan embrionik manusia adalah hubungan yang erat antara embrio dan ibu. Untuk bertahan hidup dan tumbuh selama kehidupan intrauterin, embrio harus mempertahankan hubungan yang pada dasarnya bersifat parasit dengan tubuh ibu karena mendapatkan oksigen dan nutrisi dari ibu dan melakukan ekskresi pada sistem ibunya. Selain itu, embrio juga dianggap bagian dari tubuh ibu dan tidak dianggap sebagai menda asing oleh sistem kekebalan tubuh dari ibu. Persyaratan ini dipenuhi oleh plasenta dan membran ekstraembrionik yang mengelilingi embrio dan berfungsi sebagai penghubung antara embrio dan ibu.
Jaringan yang menyusun hubungan janin-ibu (plasenta dan chorion) adalah turunan dari trofoblas, yang terpisah dari inner cell mass serta mengelilingi prekursor seluler embrio bahkan ketika zygote yang memulai pembelahan dan melewati uterus saat bergerak ke dinding rahim untuk proses pelekatan. Jaringan ekstraembrionik lainnya berasal dari inner cell mass. Jaringan ekstraembrionik lainnya yaitu Amnion (turunan ektoderma), membentuk kapsul yang dipenuhi cairan pelindung di sekitar embrio; Kantung Yolk (turunan endoderm), dalam embrio mamalia tidak lagi melayani fungsi gizi primer; Allantois (turunan endoderm), yang terkait dengan manajemen limbah embrionik; dan sebagian besar mesoderm ekstraembrionik, yang membentuk sebagian besar tali pusat dengan dukungan jaringan ikat dari membran ekstraembrionik, serta pembuluh darah yang memasoknya.
Jaringan Ekstra Embrionik
Amnion
Ketika pada perkembangan awal embrio, embrio mengalami lipatan cephalocaudal dan lateral, membran ketuban (amniotik) mengelilingi tubuh embrio seperti balon yang berisi cairan, sehingga memungkinkan embrio bergantung pada lingkungan cair selama durasi kehamilan. Cairan ketuban (amniotik) berfungsi sebagai buffer untuk menghindari cedera mekanis pada janin; Selain itu, cairan ini juga mengakomodasi pertumbuhan, memungkinkan pergerakan normal janin, dan melindungi janin dari adhesi. Membran tipis amniotik terdiri dari satu lapisan sel ektoderm ekstraembrionik yang dilapisi oleh lapisan mesoderm ekstraembrionik yang tidak bervaskularisasi (tidak memiliki pembuluh). Untuk mengikuti pertumbuhan janin, rongga amniotik terus mengembang sampai cairan kandungan mencapai maksimum hampir 1 Liter pada minggu ke-33 hingga ke-34 kehamilan.
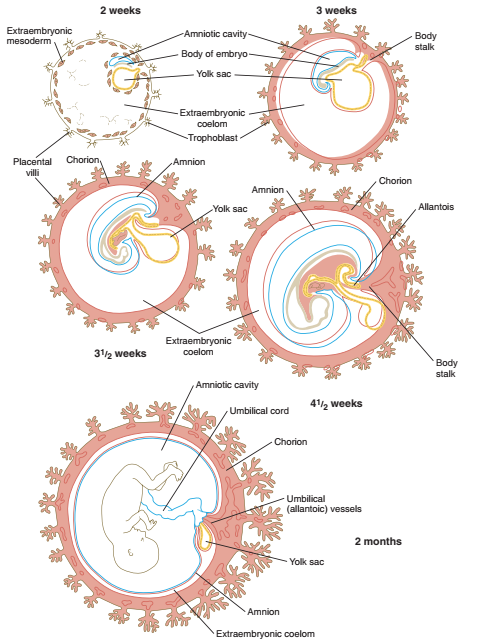
Gambar. Embrio manusia yang menunjukkan hubungan antara chorion dan membran ekstra embrionik lainnya
Pada berbagai sumber informasi, cairan ketuban (amniotik) dapat dipandang sebagai transudat (cairan) encer dari plasma ibu, tetapi asal-usul dan dinamika pertukaran cairan ketuban (amniotik) terjadi dengan sangat kompleks dan tidak sepenuhnya dapat dijelaskan saat ini. Ada dua fase dalam produksi cairan ketuban (amniotik). Fase pertama terjadi pada 20 minggu pertama kehamilan, di mana komposisi cairan ketuban (amniotik) sangat mirip dengan cairan janin. Selama periode ini, ada bukti bahwa cairan dan elektrolit dapat berdifusi secara bebas melalui lapisan ektoderm embrionik. Selain itu, membran amniotik itu sendiri mengeluarkan cairan, dan komponen serum maternal melewati membran amniotik.
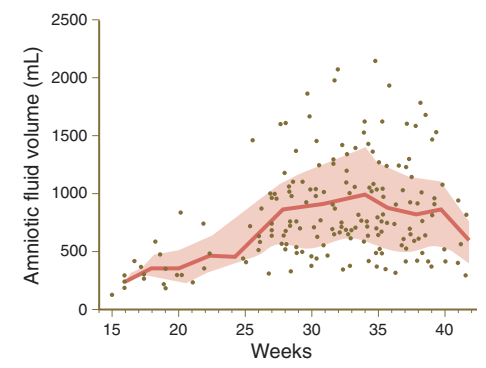
Gambar. Volume cairan amniotik meningkat seiring dengan meningkatnya umur kehamilan
Seiring dengan perkembangan kehamilan (terutama setelah minggu ke-20, ketika epidermis janin mulai terkeratinasi), perubahan terjadi pada sumber cairan ketuban (amniotik). Ada peningkatan kontribusi dari urin janin, filtrasi dari pembuluh darah ibu di dekat chorion (yang terkait erat dengan membran ketuban (amniotik)), dan mungkin dilakukan proses penyaringan dari pembuluh janin pada tali pusat dan lempeng chorionic.
Pada trimester ketiga kehamilan, cairan ketuban (amniotik) berbalik sepenuhnya setiap 3 jam, dan pada saat itu, laju pertukaran cairan dapat mendekati 500 mL/jam. Meskipun banyak cairan ketuban (amniotik) dipertukarkan melintasi membran ketuban, menelan cairan adalah mekanisme penting pada akhir kehamilan, dengan sekitar 20 ml/jam cairan yang ditelan oleh janin. Cairan ketuban yang ditelan akhirnya memasuki aliran darah janin setelah penyerapan melalui dinding usus. Cairan yang tertelan dapat meninggalkan sirkulasi janin melalui plasenta. Selama periode janin, urin yang dikeluarkan dari janin berkontribusi terhadap cairan ketuban.
Secara tradisional, membran amniotik telah dibuang bersama dengan plasenta dan jaringan ekstraembrionik lainnya ketika janin dilahirkan. Namun, dalam beberapa tahun terakhir, peran medis yang penting telah ditemukan untuk selaput amniotik ini. Karena sifat amnion yang anti-inflamasi dan antiangiogenik, lembaran amnion telah banyak digunakan untuk pengobatan berbagai penutup luka atau permukaan luka bakar, terutama pada bedah mata. Amnion, serta cairan ketuban dan jaringan plasenta lainnya, telah terbukti menjadi sumber utama stem cell, yang memiliki kemampuan membedakan dan dapat menjadi jenis sel dari masing -masing dari tiga lapisan germ layers.
Kantung Yolk
Kantung yolk, yang dilapisi oleh endoderm ekstraembrionik, terbentuk ventral ke embrio dan berlapis -lapis ketika amnion muncul dorsal ke lempeng embrionik. Berbeda dengan burung dan reptil, kantung yolkmamalia berukuran kecil dan tanpa yolk. Meskipun fungsi utamanya sebagai sumber nutrisi, kantung yolktetap vital bagi embrio karena memiliki fungsi lain yang berkaitan dengan kantung yolk. Beberapa bukti menunjukkan bahwa sebelum sirkulasi plasenta terbentuk, nutrisi, seperti asam folat dan vitamin A, B12, dan E, terkonsentrasi pada kantung yolkdan diserap melalui mekanisme endositosis. Karena bentuk nutrisi histiotrofik (Suatu organisme yang memperoleh kebutuhan nutrisi dari zat organik yang kompleks) ini terjadi selama masa neurulasi, kantung yolk dapat berperan dalam pencegahan terjadinya cacat tabung saraf.
Ketika pertama kali muncul, kantung yolk dalam bentuk belahan yang dibatasi di daerah ekuatorial oleh dinding dorsal usus primitif (usus yang awal terbentuk). Ketika embrio tumbuh dan mengalami lipatan lateral dan melengkung di sepanjang sumbu craniocaudal, hubungan antara kantung yolk dan pembentukan usus menjadi semakin kecil dan berbentuk seperti batang yang semakin menyempit dan melekat pada kantung yolk pada ujung distal. Dalam minggu berikutnya, tangkai yolk menjadi sangat panjang karena dimasukkan ke dalam tubuh tali pusat. Kantung yolk itu sendiri bergerak lebih dekat dengan pelat korionik plasenta.
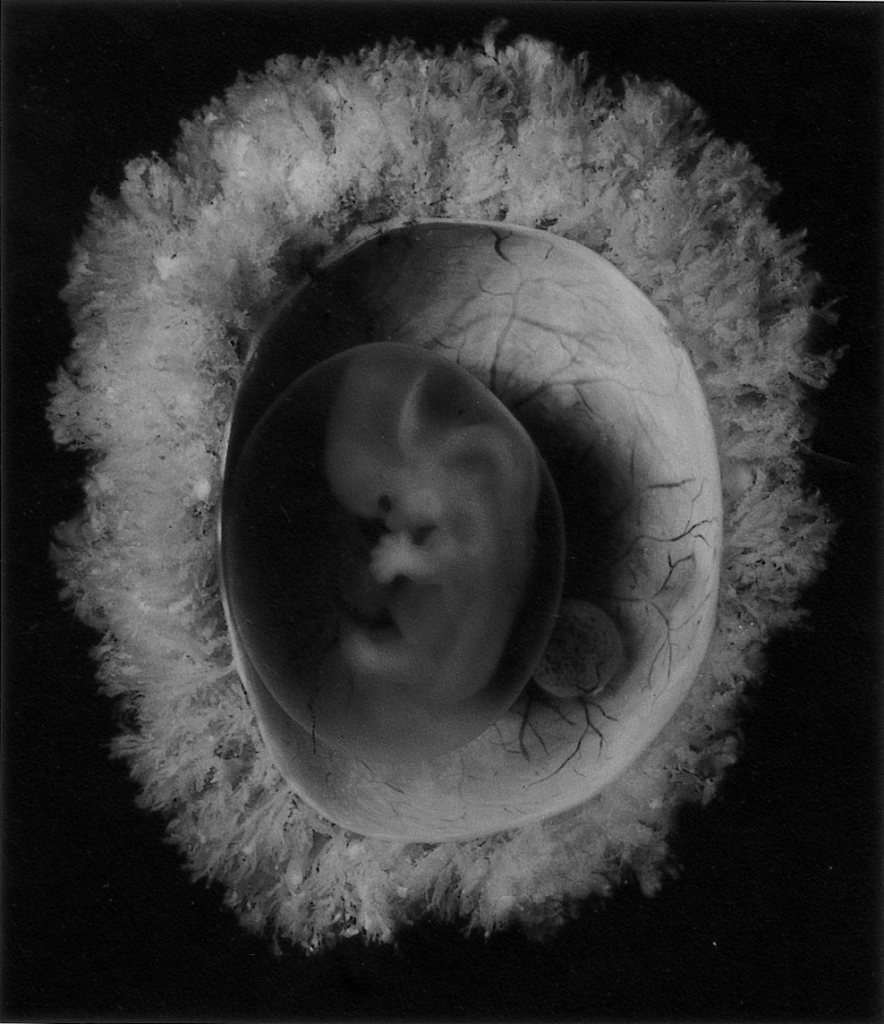
Gambar. Ambion mengelilingi embrio manusia pada umur kehamilan 7 minggu
Endoderm dari kantung yolk dilapisi di bagian luar oleh mesoderm ekstraembrionik yang bervaskularisasi dengan baik. Sel yang ditemukan pada lapisan ini berkontribusi sebagai komponen vital pada tubuh embrio. Selama minggu ketiga, germ cell primordial, yang muncul di mesoderm ekstraembrionik di dekat pangkal allantois, dikenali dalam lapisan kantung yolk. Segera setelah itu, sel-sel ini bermigrasi ke dinding usus dan mesenterium dorsal saat sel ini menuju ke gonad, di mana sel ini akan berdiferensiasi menjadi oogonia atau spermatogonia.
Sementara itu, kelompok sel mesodermal ekstraembrionik pada dinding kantung yolk diatur ke pulau darah dan banyak sel berdiferensiasi menjadi sel darah primitif. Hematopoiesis ekstraembrionik berlanjut di kantung yolk sampai sekitar minggu keenam kehamilan, ketika aktivitas pembentukan darah ditransfer ke situs intraembrionik, terutama hati. Saat usus tubular terbentuk, tempat tangkai yolk menjadi semakin kurang menonjol, sampai 6 minggu kehamilan secara efektif kehilangan kontak dengan usus. Dalam sebagian kecil orang dewasa, jejak saluran yolk bertahan sebagai tali berserat atau outpouching usus kecil yang dikenal sebagai divertikulum Meckel. Kantung yolk itu sendiri dapat bertahan sepanjang kehamilan, tetapi tidak diketahui fungsi spesifiknya dalam periode janin. Bagian proksimal dari pembuluh darah di kantung yolk (busur sirkulasi vitelline) bertahan sebagai pembuluh yang memasok wilayah midgut selama fase perkembangan.
Allantois
Allantois muncul sebagai outpocketing ventral endodermal dari hindgut. Dalam embrio manusia, allantois hanyalah sisa dari struktur besar, mirip kantung yang digunakan oleh embrio banyak mamalia, burung, dan reptil sebagai organ pernapasan utama dan gudang untuk limbah urin. Mirip dengan kantung yolk, allantois pada manusia hanya mempertahankan fungsi sekunder, dalam hal ini respirasi. Pada manusia, fungsi ini ditanggung jawabi oleh pembuluh darah yang berdiferensiasi dari dinding mesodermal allantois. Pembuluh-pembuluh ini membentuk busur peredaran darah umbilikalis, yang terdiri dari arteri dan vena yang memasok plasenta. Allantois tertanam dalam tali pusat. Kemudian dalam perkembangannya, bagian proksimal allantois (disebut urachus) selanjutnya berperan pada pembentukan kandung kemih. Setelah janin lahir, allantois diubah menjadi tali berserat yang padat (ligamen umbilikalis median), yang membentang dari kandung kemih ke daerah umbilikalis.
Chorion dan Plasenta
Pembentukan kompleks plasenta merupakan upaya kerja sama antara jaringan ekstraembrionik embrio dan jaringan endometrium ibu. Setelah proses implantasi selesai, trofoblas yang mengelilingi embrio telah mengalami diferensiasi menjadi dua lapisan: sitotrofoblas bagian dalam dan sinsitiotrofoblas luar. Lakuna dalam trofoblas yang berkembang pesat telah terisi dengan darah ibu, dan sel-sel jaringan ikat endometrium telah mengalami reaksi desidua (mengandung peningkatan jumlah glikogen dan lipid) sebagai respons terhadap invasi trofoblas.
Pembentukan Vili Chorionic
Pada embrio implantasi awal, jaringan trofoblas tidak memiliki ciri morfologi yang konsisten; akibatnya, tahapan ini disebut dengan periode embrio pravili. Pada akhir minggu kedua kehamilan, proyeksi sitotrofoblas yang disebut vili primer mulai terbentuk. Tak lama kemudian, inti mesenkim muncul di dalam vili yang membesar, yang disebut dengan vili sekunder. Di sekeliling inti mesenkim dari vili sekunder adalah lapisan lengkap sel sitotrofoblas, dan di luarnya adalah sinsitiotrofoblas. Menurut definisi, vili sekunder menjadi vili tersier ketika pembuluh darah menembus inti mesenkimnya dan cabang-cabang yang baru terbentuk. Peristiwa ini terjadi menjelang akhir minggu ketiga kehamilan.
Bagian terminal vili tetap trofoblas, terdiri dari massa padat sitotrofoblas yang disebut sel kolom sitotrofoblas dan selubung sinsitiotrofoblas yang relatif tipis di atasnya. Villus bermandikan darah ibu. Perkembangan lebih lanjut dari ujung vili terjadi ketika, di bawah pengaruh lingkungan hipoksia lokal, kolom sel sitotrofoblas meluas ke distal dan menembus lapisan sinsitiotrofoblas. Sel-sel sitotrofoblas ini berbatasan langsung dengan sel desidua ibu dan menyebar di atasnya untuk membentuk lapisan seluler lengkap yang dikenal sebagai cangkang sitotrofoblas, yang mengelilingi kompleks embrio. Vili yang mengeluarkan perpanjangan sitotrofoblas dikenal sebagai anchoring vili karena mewakili titik perlekatan nyata antara kompleks embrio dan jaringan ibu.
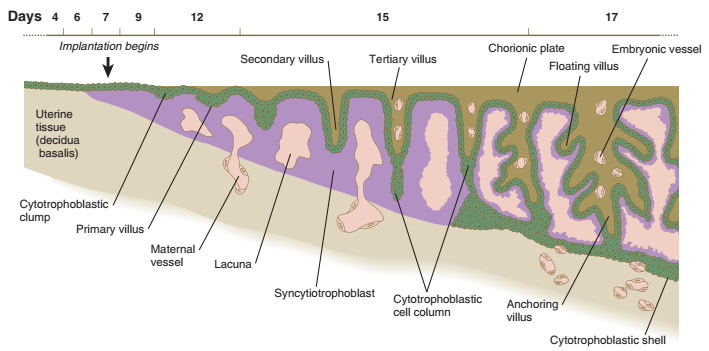
Gambar. Tahapan dalam pembentukan villus korionik, mulai dengan rumpun sitotrofoblas jauh di sebelah kiri dan berkembang dari waktu ke waktu ke Anchoring villus di kanan.
Penting untuk memahami hubungan keseluruhan dari berbagai jaringan embrionik dan ibu pada tahap perkembangan ini. Embrio, yang dilekatkan oleh batang tubuh, atau tali pusat, secara efektif tersuspensi dalam rongga chorion. Rongga chorion dibatasi oleh lempeng chorion, yang terdiri dari mesoderm ekstraembrionik yang dilapisi dengan trofoblas. Vili chorion memanjang keluar dari lempeng chorion, dan penutup trofoblasnya berlanjut dengan lapisan chorion. Vili dan permukaan luar lempeng chorionic kaya akan darah ibu yang terus bertukar. Karena itu, plasenta manusia ditetapkan sebagai tipe hemokorial.
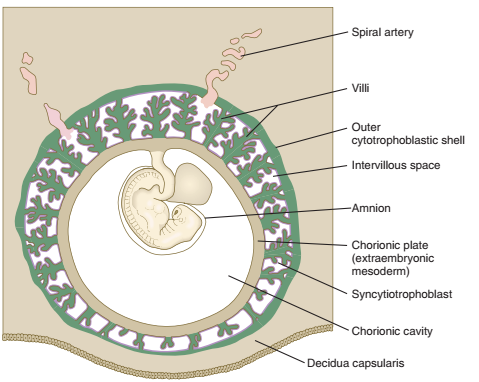
Gambar. Keseluruhan tampilan dari embrio berumur 5 minggu di samping membran menunjukkan hubungan dari plate chorionic, vili, dan kulit luar sitotrofoblas .
Meskipun vili chorionic secara struktural sangat rumit, akan lebih mudah untuk menyamakan struktur dasar kompleks vili dengan sistem akar tanaman. Anchoring vili setara dengan akar tunggang pusat; melalui kolom sel sitotrofoblas, anchoring vili menempelkan kompleks vili ke kulit luar sitotrofoblas. Cabang-cabang tidak terikat dari vili yang mengambang menjuntai bebas dalam darah ibu yang mengisi ruang antara lempeng chorionic dan cangkang sitotrofoblas luar. Semua permukaan vili, lempeng chorionic, dan cangkang sitotrofoblas yang bersentuhan dengan darah ibu dilapisi dengan lapisan sinsitiotrofoblas terus menerus.
Membangun sirkulasi uteroplasental
Salah satu fitur penting dari permukaan embrionik maternal yang berkembang adalah terbentuknya sirkulasi uteroplasenta yang berfungsi sebagai media untuk membawa makanan dan oksigen dan membuang limbah dari embrio. Hal ini diperoleh dengan erosi dinding arteri spiralis uterus dan modifikasinya sehingga, saat embrio tumbuh, arteri ini dapat memberikan peningkatan aliran darah pada tekanan rendah untuk membasahi permukaan sinsitiotrofoblas plasenta. Sel sitotrofoblas invasif khusus, bermigrasi keluar dari anchoring vili, menginvasi arteri spiralis (tetapi bukan vena) dan menyebabkan modifikasi besar pada dindingnya dengan mensekresikan matriks ekstraseluler khusus serta menggantikan banyak elemen seluler normal dari arteri spiralis. Akibatnya, arteri menjadi lebih lebar, tetapi darah yang keluar dari ujung yang terbuka meninggalkan tekanan yang jauh lebih rendah daripada tekanan arteri normal.
Cairan ibu pertama yang membasahi trofoblas embrionik tidak terlalu seluler, dan tekanan oksigennya rendah. Selama periode ini, eritrosit janin mengandung hemoglobin embrionik, yang disesuaikan untuk mengikat oksigen di bawah tekanan rendah.
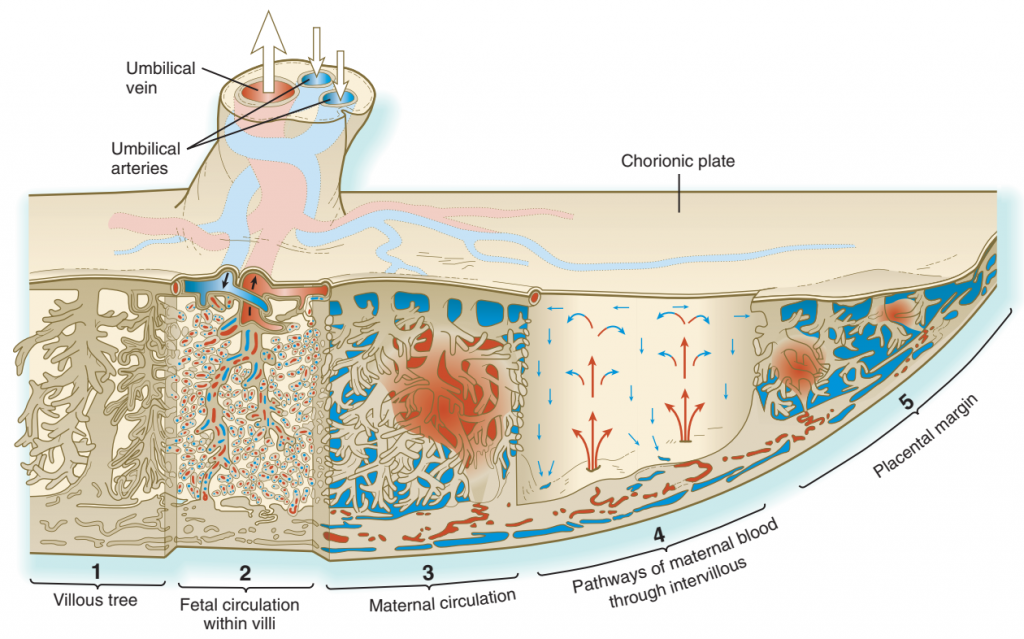
Gambar. Struktur dan sirkulasi plasenta manusia yang telah matang. Darah memasuki ruang antar vili ujung terbuka dari uterus spiral arteri. Setelah dibasahi, vili, darah (biru), dikeringkan melalui vena endometrium.
Hipoksia merangsang sel sitotrofoblas untuk mengalami mitosis. Ini mungkin salah satu kondisi lingkungan yang mendasari cepatnya pertumbuhan sitotrofoblas selama periode embrionik awal. Setelah 12 minggu kehamilan, ketika darah ibu di plasenta mengandung sejumlah besar eritrosit dan lebih banyak teroksigenasi, eritrosit janin, melalui sakelar isoform, mulai memproduksi hemoglobin janin, yang membutuhkan tekanan oksigen yang lebih tinggi untuk mengikat oksigen secara efisien. Darah ibu yang meninggalkan arteri spiralis dengan bebas meresap ke seluruh ruang intervili dan membasahi permukaan vili. Darah ibu kemudian diambil oleh ujung vena uterina yang terbuka, yang juga menembus cangkang sitotrofoblas.
Hubungan kotor jaringan korionik dan desidual
Setelah beberapa hari implantasi embrio, sel-sel stroma endometrium mengalami transformasi mencolok yang disebut reaksi desidua. Setelah sel-sel stroma membengkak akibat akumulasi glikogen dan lipid dalam sitoplasmanya, sel ini dikenal sebagai sel desidua. Reaksi desidua menyebar ke seluruh sel stroma di lapisan superfisial endometrium. Desidua ibu diberi nama topografi berdasarkan di mana mereka berada dalam kaitannya dengan embrio.
Jaringan desidua yang menutupi embrio dan vesikula chorionic-nya adalah desidua kapsularis, sedangkan desidua yang terletak di antara vesikel korionik dan dinding rahim adalah desidua basalis. Dengan berlanjutnya pertumbuhan embrio, desidua basalis menjadi bagian dari komponen maternal plasenta definitif. Desidua yang tersisa, yang terdiri dari jaringan endometrium desidualisasi di sisi rahim yang tidak ditempati oleh embrio, adalah desidua parietalis.
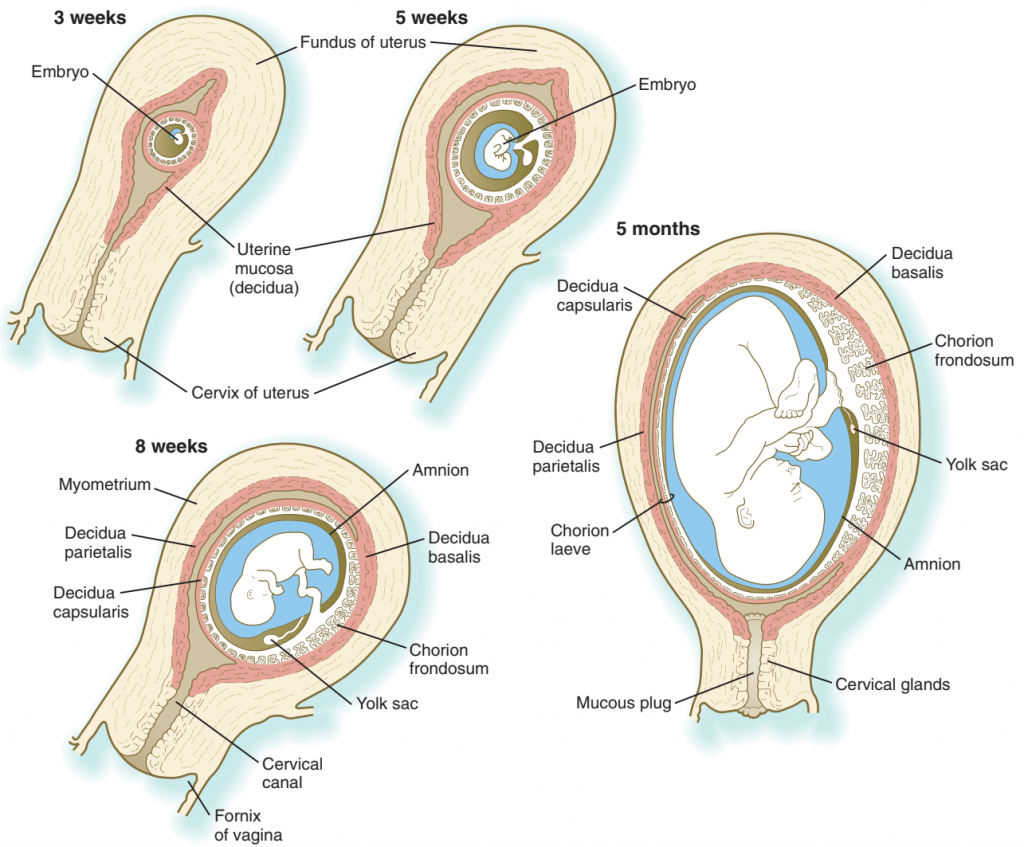
Gambar. Hubungan antara embrio dan ibu desidua (merah muda) dari minggu-minggu awal kehamilan sampai bulan kelima. Pada janin berusia 5 bulan, plasenta diwakili oleh jaringan putih di sebelah kanan janin.
Dalam embriologi manusia, chorion didefinisikan sebagai lapisan yang terdiri dari trofoblas dan mesoderm ekstraembrionik yang mendasarinya. Chorion membentuk penutup lengkap (vesikel chorionic) yang mengelilingi embrio, amnion, kantung kuning telur, dan batang tubuh. Selama periode awal setelah implantasi, vili primer dan sekunder menonjol hampir seragam dari seluruh permukaan luar vesikel korionik. Pembentukan vili tersier adalah asimetris dan invasi inti sitotrofoblas vili primer oleh mesenkim dan pembuluh darah embrio terjadi terutama di vili primer yang terletak paling dekat dengan desidua basalis. Karena vili ini terus tumbuh dan bercabang, vili yang terletak di sisi berlawanan (kutub abembrionik) dari vesikel korionik gagal untuk mengikuti dan akhirnya atrofi karena kompleks embrio yang sedang tumbuh menonjol ke dalam rongga rahim. Daerah yang mengandung vili chorionic berkembang dan yang akhirnya menjadi plasenta adalah chorion frondosum. Sisa chorion, yang akhirnya menjadi halus, adalah chorion laeve.
Salah satu mekanisme yang disarankan untuk pembentukan chorion laeve didasarkan pada stres oksidatif. Lingkungan embrio awal yang normal kira-kira mengandung 3% oksigen, berlawanan dengan tingkat oksigen atmosfer normal yang berkisar 21%. Arteri spiralis uterina di daerah chorion laeve tidak tertutup rapat oleh sumbat sitotrofoblas seperti di bawah area plasenta. Situasi ini menyebabkan peningkatan lokal yang signifikan dalam konsentrasi oksigen, sehingga menyebabkan degenerasi sinsitiotrofoblas yang menutupi vili dan regresi sirkulasi kapiler di dalamnya sebagai akibat dari stres oksidatif.
Pertumbuhan keseluruhan vesikel chorionic, dengan penonjolannya ke dalam lumen uterus, mendorong desidua kapsularis semakin jauh dari pembuluh darah endometrium. Pada akhir trimester pertama kehamilan, desidua capsularis itu sendiri mengalami atrofi. Pada bulan berikutnya, bagian dari desidua kapsularis yang atrofi mulai menghilang dan meninggalkan lapisan korion yang mengalami kontak langsung dengan desidua parietalis di sisi berlawanan dari uterus. Pada pertengahan kehamilan, desidua kapsularis telah menyatu dengan jaringan desidua parietalis, sehingga secara efektif menghilangkan kavum uteri asli. Sementara chorion laeve dan desidua kapsularis mengalami atrofi progresif, plasenta terbentuk dalam bentuk definitifnya dan bertindak sebagai tempat pertukaran utama antara ibu dan embrio.
Formasi dan Struktur Plasenta Matang
Ketika perbedaan antara chorion frondosum dan chorion laeve menjadi lebih menonjol, batas-batas plasenta yang tepat dapat ditentukan. Plasenta terdiri dari komponen janin dan ibu. Komponen janin adalah bagian dari vesikel chorionic yang diwakili oleh chorion frondosum. Ini terdiri dari dinding chorion, yang disebut lempeng chorionic, dan vili chorionic yang muncul dari wilayah itu. Komponen ibu diwakili oleh desidua basalis, tetapi yang menutupi desidua basalis adalah cangkang sitotrofoblas luar yang diturunkan dari janin. Ruang intervili antara komponen janin dan ibu dari plasenta ditempati oleh darah ibu yang bersirkulasi secara bebas. Sesuai dengan fungsi utamanya, keseluruhan struktur plasenta diatur untuk menyediakan area permukaan yang sangat besar (>10 m2) untuk pertukaran tersebut.
Struktur Plasenta Matang
Plasenta matang berbentuk seperti cakram, tebal 3 cm, dan diameter sekitar 20 cm. Plasenta khas memiliki berat sekitar 500 g. Sisi janin dari plasenta mengkilat karena adanya selaput ketuban. Dari sisi janin, perlekatan tali pusat ke lempeng chorionic dan cabang-cabang plasenta yang besar dari arteri dan vena umbilikalis terlihat jelas. Sisi ibu dari plasenta kusam dan dibagi menjadi 35 lobus. Alur antar lobus ditempati oleh septa plasenta, yang muncul dari desidua basalis dan meluas ke arah lempeng basal. Di dalam lobus plasenta terdapat beberapa kotiledon, yang masing-masing terdiri dari vili batang utama dan semua cabangnya. Ruang antarvilus di setiap lobus mewakili kompartemen yang hampir terisolasi dari sirkulasi ibu ke plasenta.
Tali Pusar
Tangkai tubuh yang awalnya lebar memanjang dan menjadi lebih sempit saat kehamilan berlanjut. Tali pusat menjadi saluran untuk pembuluh darah pusat, yang melintasi panjangnya antara janin dan plasenta. Pembuluh darah umbilicus tertanam dalam jaringan ikat mukoid yang sering disebut Wharton’s Jelly. Tali pusat, yang biasanya mencapai panjang 50 sampai 60 cm pada akhir kehamilan, biasanya memuntir berkali-kali. Pemuntiran dapat dilihat dengan pemeriksaan kasar pembuluh darah umbilikalis. Pada sekitar 1% kehamilan, simpul sejati terjadi di tali pusat. Jika mereka mengencang akibat gerakan janin, mereka dapat menyebabkan anoksia dan bahkan kematian janin. Kadang-kadang, tali pusat mengandung dua vena umbilikalis jika vena umbilikalis kanan tidak mengalami degenerasi normal. Sekitar 0,5% dari tali pusat dewasa hanya mengandung satu arteri umbilikalis. Kondisi ini dikaitkan dengan 15% sampai 20% insiden terkait cacat kardiovaskular pada janin.
Sirkulasi Plasenta
Baik janin maupun ibu berkontribusi pada sirkulasi plasenta. Sirkulasi janin terkandung dalam sistem pembuluh umbilikalis dan plasenta. Darah janin mencapai plasenta melalui dua arteri umbilikalis, yang bercabang di seluruh plat chorionic. Cabang -cabang yang lebih kecil dari arteri ini memasuki vili chorionic dan pecah menjadi jaringan kapiler di cabang terminal vili chorionic, di mana pertukaran komponen dengan darah ibu terjadi. Dari lapisan kapiler villous, pembuluh darah mengkonsolidasikan ke dalam cabang vena yang lebih besar secara berturut -turut.
Berbeda dengan sirkulasi janin yang sepenuhnya terkandung dalam pembuluh darah, suplai darah ibu ke plasenta seperti danau yang mengalir bebas yang tidak dibatasi oleh dinding pembuluh darah. Sebagai hasil dari aktivitas invasif trofoblas, sekitar 80 hingga 100 arteri spiral endometrium terbuka secara langsung ke ruang intervillous dan vili dalam sekitar 150 ml darah ibu, yang bertukar 3 hingga 4 kali setiap menitnya.
Darah ibu memasuki ruang intervillous di bawah berkurangnya tekanan karena sitotrofoblastik yang sebagian menghindari lumens arteri spiral. Namun demikian, tekanan darah ibu cukup untuk memaksa darah di pembuluh arteri ibu yang teroksigenasi ke villous di lempeng chorionic. Tekanan keseluruhan pada darah plasenta ibu sekitar 10 mm/Hg di dalam rahim yang tenang. Dari pelat chorionic, darah meresap di atas vili terminal saat kembali ke jalur aliran keluar vena yang terletak di plat decidual (ibu) plasenta. Aliran darah ibu yang memadai ke plasenta sangat penting untuk pertumbuhan dan perkembangan janin, dan penurunan suplai darah ibu ke plasenta menyebabkan janin memiliki ukuran yang kecil.
Fisiologi Plasenta
Pengangkutan zat antara plasenta dan darah ibu yang yang difasilitasi oleh luas permukaan plasenta yang besar, yang mengembang mulai dari 5 m2 pada 28 minggu kehamilan hingga menjadi hampir 11 m2. Sekitar 5% hingga 10% dari permukaan plasenta manusia terdiri dari area yang tersebar di mana penghalang antara darah janin dan ibu sangat tipis, dengan ketebalan hanya beberapa mikrometer saja. Area ini, kadang disebut sebagai plat epitel, yang merupakan adaptasi morfologis yang dirancang untuk memfasilitasi difusi zat antara sirkulasi janin dan ibu.
Transfer zat terjadi dua arah di seluruh plasenta. Sebagian besar zat yang ditransfer dari ibu ke janin terdiri dari oksigen dan nutrisi. Plasenta menjadi sarana untuk pembuangan akhir karbon dioksida dan bahan limbah janin lainnya ke dalam sirkulasi ibu. Dalam beberapa keadaan, beberapa zat yang di antaranya berbahaya, dapat ditransfer melintasi plasenta.
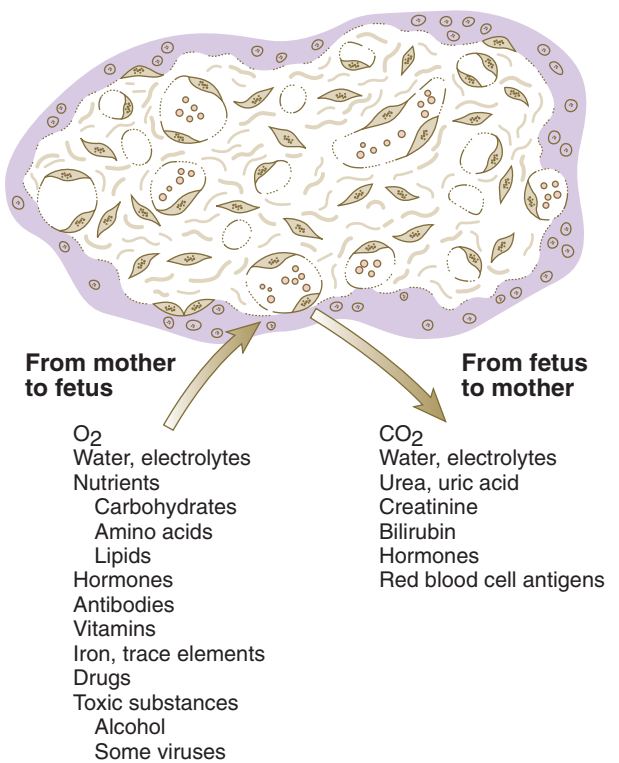
Gambar. Pertukaran zat melintasi plasenta antara sirkulasi janin dan ibu.
Gas, terutama oksigen dari ibu dan karbon dioksida dari janin, dengan mudah dapat melintasi penghalang plasenta dengan difusi. Jumlah pertukaran lebih terbatas oleh aliran darah daripada oleh efisiensi difusi. Plasenta juga bersifat permeabel terhadap karbon monoksida dan banyak anestesi inhalasi. Anestesi inhalasi dapat mengganggu transisi fungsi bayi yang baru lahir ke independen (mis., Pernapasan) jika agen -agen ini digunakan selama persalinan. Seperti gas, air dan elektrolit juga mudah ditransfer melintasi plasenta. Tingkat transfer dimodifikasi oleh tekanan osmotik koloid dan fungsi saluran ion. Limbah janin (mis., Urea, kreatinin, bilirubin) dengan cepat ditransfer melintasi plasenta melalui sirkulasi janin ke darah ibu melalui vili. Meskipun plasenta sangat permeabel terhadap nutrisi tertentu, seperti glukosa, yang merupakan sumber energi utama untuk janin, plasenta jauh lebih sedikit permeabel terhadap fruktosa dan beberapa disakarida umum. Asam amino diangkut melewati plasenta melalui aksi reseptor spesifik. Vitamin, terutama yang larut dalam air, ditransfer dari sirkulasi ibu ke janin.
Hormon steroid melintasi pembatas plasenta dari darah ibu. Anak laki -laki yang baru lahir menunjukkan bukti efek paparan hormon seks ibu. Hormon protein, secara umum, kurang diangkut melintasi plasenta, meskipun gejala diabetes ibu dapat berkurang selama kehamilan akhir karena insulin yang diproduksi oleh janin. Hormon tiroid ibu memperoleh akses lambat ke janin.
Beberapa protein ditransfer dengan sangat lambat melalui plasenta, terutama dengan menggunakan pinositosis (serapan oleh vesikel membran dalam sel). Yang sangat penting adalah transfer antibodi ibu, terutama dari kelas imunoglobulin G (IgG). Karena sistem kekebalan tubuhnya yang belum matang, janin hanya menghasilkan sejumlah kecil antibodi. Transfer transplasental antibodi IgG dimulai pada usia 12 minggu kehamilan dan meningkat secara progresif dari waktu ke waktu, dengan tingkat transfer antibodi terbesar terjadi pada 34 minggu kehamilan. Karena alasan ini, bayi yang lahir sebelum waktunya tidak menerima tingkat antibodi ibu yang sepenuhnya dapat melindunginya. Transfer antibodi dari ibu memberikan kekebalan pasif dari bayi yang baru lahir ke penyakit masa kanak -kanak tertentu, seperti cacar, difteri, dan campak, sampai sistem kekebalan tubuh bayi mulai berfungsi lebih efisien. Protein ibu lainnya, transferin, penting karena ia membawa zat besi ke janin. Permukaan plasenta mengandung reseptor spesifik untuk protein ini. Besi (Fe) ternyata dipisahkan dari pembawa transferin di permukaan plasenta dan kemudian secara aktif diangkut ke jaringan janin.
Sekresi dan Sintesis Hormon Plasenta
Plasenta, khususnya syncytiotrophoblas, adalah organ endokrin yang penting selama proses kehamilan. Plasenta menghasilkan hormon protein dan steroid.
Hormon protein pertama yang diproduksi adalah Human Chorionic Gonadotropin (HCG), yang bertanggung jawab untuk mempertahankan corpus luteum dan produksi progesteron dan estrogen. Dengan adanya sintesis HCG bahkan sebelum implantasi, keberadaan hormon ini dalam urin ibu digunakan sebagai dasar untuk banyak tes kehamilan. Produksi puncak HCG pada sekitar minggu kedelapan kehamilan dan kemudian secara bertahap menurun. Pada akhir trimester pertama, plasenta menghasilkan progesteron dan estrogen yang cukup sehingga kehamilan dapat dipertahankan bahkan jika corpus luteumis diangkat dengan pembedahan. Plasenta dapat secara independen mensintesis progesteron dari prekursor asetat atau kolesterol, tetapi tidak mengandung mekanisme enzimatik lengkap untuk sintesis estrogen. Agar estrogen disintesis, plasenta harus beroperasi dengan kelenjar adrenal janin dan mungkin hati; Struktur -struktur ini memiliki enzim yang tidak dimiliki plasenta.
Hormon protein plasenta lainnya adalah chrionic somato-mammammotropin, yang juga disebut human placental lactogen. Mirip dalam struktur dengan hormon pertumbuhan manusia, chrionic somatomammammotropin mempengaruhi pertumbuhan, laktasi, dan metabolisme lipid dan karbohidrat. Plasenta juga menghasilkan sejumlah kecil thyrotropin dan kortikotropin chorionic. Ketika disekresikan ke dalam aliran darah ibu, beberapa hormon plasenta merangsang perubahan dalam metabolisme dan fungsi kardiovaskular ibu. Perubahan ini memastikan bahwa jenis dan jumlah nutrisi serta substrat mendasar yang tepat mencapai plasenta untuk transportasi ke janin.
Dalam hal tertentu, plasenta menduplikasi sistem kontrol bertingkat yang mengatur produksi hormon di badan pascanatal. Sel-sel sitotrofoblas menghasilkan homolog hormon pelepas gonadotropin (GnRH), seperti biasanya dilakukan oleh hipotalamus. GnRH masuk ke syncytiotrophoblas, bersama dengan peptida opiat tertentu dan reseptornya (yang telah diidentifikasi dalam syncytiotrophoblas), merangsang pelepasan HCG dari syncytiotrophoblas. Peptida opiat dan reseptornya juga terlibat dalam pelepasan somatomammammotropin korionik dari syncytiotrophoblas. Akhirnya, HCG tampaknya terlibat dalam mengatur sintesis dan pelepasan steroid plasenta dari syncytiotrophoblas. Selain hormon, plasenta menghasilkan berbagai macam protein lain yang terutama telah diidentifikasi secara imunologis. Fungsi banyak protein plasenta yang telah ditemukan masih sangat kurang dipahami.
Immunologi Plasenta
Salah satu misteri utama kehamilan adalah mengapa janin dan plasenta, yang secara imunologis berbeda dari ibu, tidak dianggap sebagai jaringan asing dan tidak ditolak oleh sistem kekebalan tubuh ibu. Meskipun ada banyak penelitian terkait ini, jawaban untuk pertanyaan ini secara pasti masih belum diketahui. Beberapa penjelasan secara luas telah disarankan untuk menjelaskan toleransi ibu yang tidak biasa terhadap kehadiran yang berkepanjangan dari embrio asing secara imunologis selama kehamilan.
Kemungkinan pertama adalah bahwa jaringan janin, terutama yang berasal dari plasenta, yang merupakan penghubung langsung antara janin dan ibu, tidak menghadirkan antigen asing ke sistem kekebalan tubuh ibu. Hingga pada taraf tertentu, hipotesis ini benar karena baik syncytiotrophoblas maupun cytotrophoblas nonvillous (cangkang sitotrofoblastik) mengekspresikan dua kelas utama dari antigen histokompatibilitas utama yang memicu respons imun host dalam penolakan cangkok jaringan asing yang khas (contoh kasus pada transplantasi organ). Antigen ini hadir pada sel janin dan dalam jaringan stroma plasenta. Ekspresi antigen histokompatibilitas minor, namun demikian, antigen minor lainnya diekspresikan pada jaringan trofoblastik. Sel -sel ini harus mampu peka terhadap sistem kekebalan tubuh ibu.
Kemungkinan besar kedua adalah bahwa sistem kekebalan tubuh ibu lumpuh selama kehamilan sehingga tidak bereaksi terhadap antigen janin yang terpapar. Namun ibu mampu memasang respons imun terhadap infeksi atau cangkok jaringan asing. Masih ada kemungkinan represi selektif dari respons imun terhadap antigen janin, meskipun respons ketidakcocokan RH menunjukkan bahwa ini tidak secara universal terjadi.
Kemungkinan ketiga adalah bahwa hambatan dekidual lokal mencegah pengakuan kekebalan terhadap janin oleh ibu atau mencapai sel -sel kekebalan yang kompeten dari ibu ke janin. Sekali lagi, ada bukti untuk penghalang kekebalan desidual yang berfungsi, tetapi dalam sejumlah besar kasus, bahwa penghalang diketahui dilanggar melalui trauma atau penyakit.
Kemungkinan keempat adalah bahwa molekul yang terbentuk pada permukaan plasenta janin mampu menonaktifkan sel T atau sel-sel imun lainnya secara lokal yang dapat menolak embrio, atau bahwa melumpuhkan respons imun seluler lokal. Pada tikus, inaktivasi regulator komplemen menghasilkan penolakan kekebalan terhadap janin. Apakah sistem serupa beroperasi selama kehamilan manusia belum diketahui.
Saat ini, penelitian diarahkan ke kondisi seperti aborsi spontan berulang dengan harapan menemukan petunjuk lebih lanjut tentang keterkaitan imunologis yang kompleks antara janin dan ibu. Yang jelas adalah bahwa ini bukan hubungan yang sederhana. Namun demikian, solusi untuk masalah ini dapat menghasilkan informasi yang dapat diterapkan pada masalah pengurangan penolakan host terhadap jaringan dan transplantasi organ.
Plasenta Setelah Kelahiran
Sekitar 30 menit setelah lahir, plasenta, selaput embrionik, dan sisa tali pusat, bersama dengan banyak decidua ibu, dikeluarkan dari rahim sebagai afterbirth. Permukaan janin plasenta halus, mengkilap, dan keabu -abuan karena amnion yang menutupi sisi janin pelat korionik. Permukaan ibu berwarna merah kusam dan dapat diselingi dengan gumpalan darah. Permukaan ibu dari plasenta harus diperiksa dengan hati -hati karena jika kotiledon hilang dan disimpan di dinding rahim, itu dapat menyebabkan pendarahan postpartum yang serius. Pengakuan jenis penyakit plasenta tertentu dapat memberikan petunjuk berharga untuk faktor intrauterin yang dapat mempengaruhi kesejahteraan bayi yang baru lahir.
Plasenta dan Berbagai Membran pada Kehamilan
Beberapa konfigurasi yang berbeda dari plasenta dan membran ekstraembrionik dimungkinkan dalam beberapa kehamilan. Kembar dizigotik atau kembar monozigotik yang dihasilkan dari pemisahan lengkap blastomer yang sangat awal dalam pembelahan, dapat memiliki plasenta dan membran yang sepenuhnya terpisah jika dua embrio yang ditanamkan jauh di dinding rahim. Sebaliknya, jika tempat implantasi berdekatan, plasenta dan chorion (yang awalnya terpisah saat implantasi) dapat menggabungkannya, meskipun sistem pembuluh darah dari dua embrio tetap terpisah.
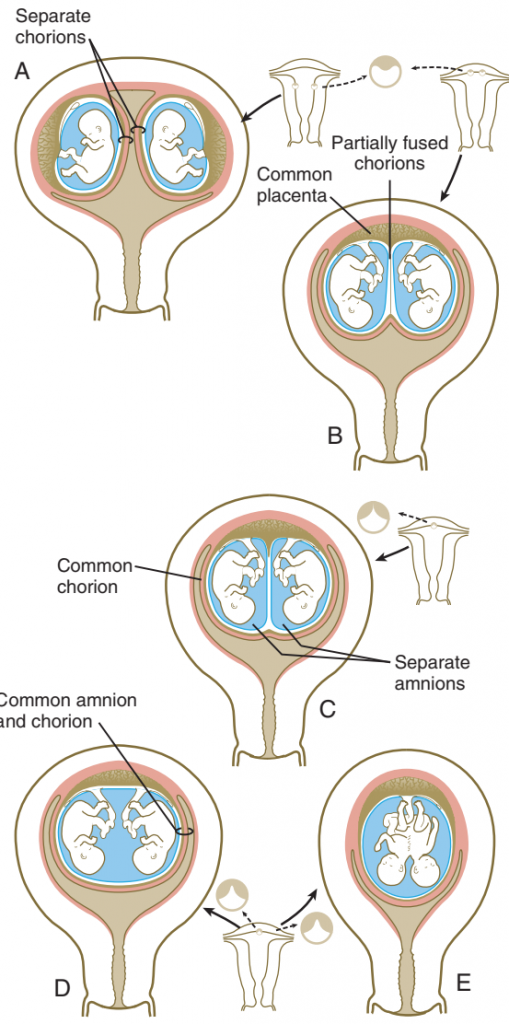
Gambar. Membran ekstraembrionik pada kehamilan kembar. (A) membran yang benar-benar terpisah pada kembar monozigot, dizygotik atau sepenuhnya terpisah, (B) plasenta menyatu umum, amnion terpisah, (C) plasenta umum yang terpisah atau umum menyatu dan amnion terpisah yang tertutup dalam chorion umum, (D)dan (E) plasenta umum dan rongga amniotik pada kembar terpisah atau kembar siam.
Ketika kembar monozigot terbentuk dengan memisahkan inner cell mass dalam blastokista, biasanya memiliki plasenta umum dan chorion umum, tetapi di dalam chorion embrio kembar masing-masing berkembang dalam amnion uamg terpisah. Dalam hal ini, ada sistem pembuluh darah yang terpisah atau menyatu dalam plasenta umum. Ketika sistem vaskular menyatu, satu kembar dapat menerima proporsi yang lebih besar dari aliran darah plasenta daripada yang lain (twin-to twin transfusion syndrome). Situasi ini dapat menyebabkan ketidakadilan pada embrio secara ringan hingga parah bagi menerima jumlah darah yang lebih rendah dari plasenta.