Regulasi Steroidogenesis
Regulasi steroidogenesis terjadi pada beberapa tingkatan, terutama pada tingkatan transkripsi gen yang mengkode enzim steroidogenik dan ko-faktor enzim tersebut serta modifikasi pasca-translasi. Pola steroidogenesis sangat spesifik pada jenis kelenjar dan variasi sel yang berperan pada regulasi ini. Apa gunanya memahami regulasi steroidogenesis? Dengan memahami steroidogenesis, kita akan memahami gangguan pada diferensiasi seksual (proses diferensiasi jenis kelamin), reproduksi, fertilitas, hipertensi, obesitas, dan homeostasis (usaha tubuh untuk mencapai keseimbangan secara konstan) fisiologis.
Kelompok Enzim Steroidogenik
Enzim steroidogenik terbesar adalah cytochrome P450 atau disebut juga dengan enzim Hydroxysteroid dehydrogenases (HSDs). Enzim ini berfungsi secara searah, sehingga produknya tidak mendorong fluks kembali ke prekursor (bahan dasar yang diubah oleh enzim menjadi produk). Semua reaksi hidroksilasi (Hidroksilasi adalah proses kimia yang memasukkan gugus hidroksil (-OH) menjadi senyawa organik) yang dimediasi oleh P450 tidak dapat diubah secara mekanis. Sebagai alternatif, reaksi HSDs secara mekanis dapat dibalik dan dapat berjalan di kedua arah dalam kondisi tertentu secara in vitro (diluar tubuh mahluk hidup). Setidaknya, dua enzim HSD menggerakkan aliran hidroksisteroid dan ketosteroid serumpunnya ke arah yang berlawanan dan menyebabkan terjadinya reduksi ketosteroid atau oksidasi hidroksisteroid.
Cytochrome Enzim P450
Sebagian besar enzim steroidogenik adalah kelompok enzim cytochrome P450. Enzim cytochrome P450 merupakan istilah umum untuk enzim oksidase yang memiliki sekitar 500 asam amino serta mengandung kelompok heme (Gambar 1). Heme merupakan gugus prostetik yang terdiri dari atom besi yang terdapat di tengah-tengah cincin organik heterosiklik yang luas yang disebut porfirin. Enzim ini disebut P450 karena merupakan singkatan dari pigmen 450, yang mampu menyerap cahaya pada panjang gelombang 450 nm dalam keadaan tereduksi. Gen yang memproduksi enzim ini disebut dengan gen CYP. Protein yang dihasilkan dari gen tersebut adalah protein CYP. Enzim cytochrome p450 mengikat substratnya dan mencapai katalisis pada wilayah aktif pada gugus heme.

Genome manusia memiliki 57 gen CYP, 7 mengkode P450 Type 1 yang ditargetkan untuk mitokondria, sedangkan 50 mengkode P450 type 2 untuk ditargetkan pada retikulum endoplasma. Meskipun organ hati menetralkan toksin endogen dan eksogen yang yang sangat banyak seperti obat-obatan, xenobiotik, dan polutan lingkungan, reaksi ini sangat sedikit dibandingkan P450 yang bisa mencapai 8x lebih banyak dan sebagian besar berpartisipasi pada proses biosintetik. Setiap enzim P450 dapat memetabolisme banyak substrat dengan berbagai macam oksidasi. Untuk memahami cara kerja enzim, cek Gambar 2.
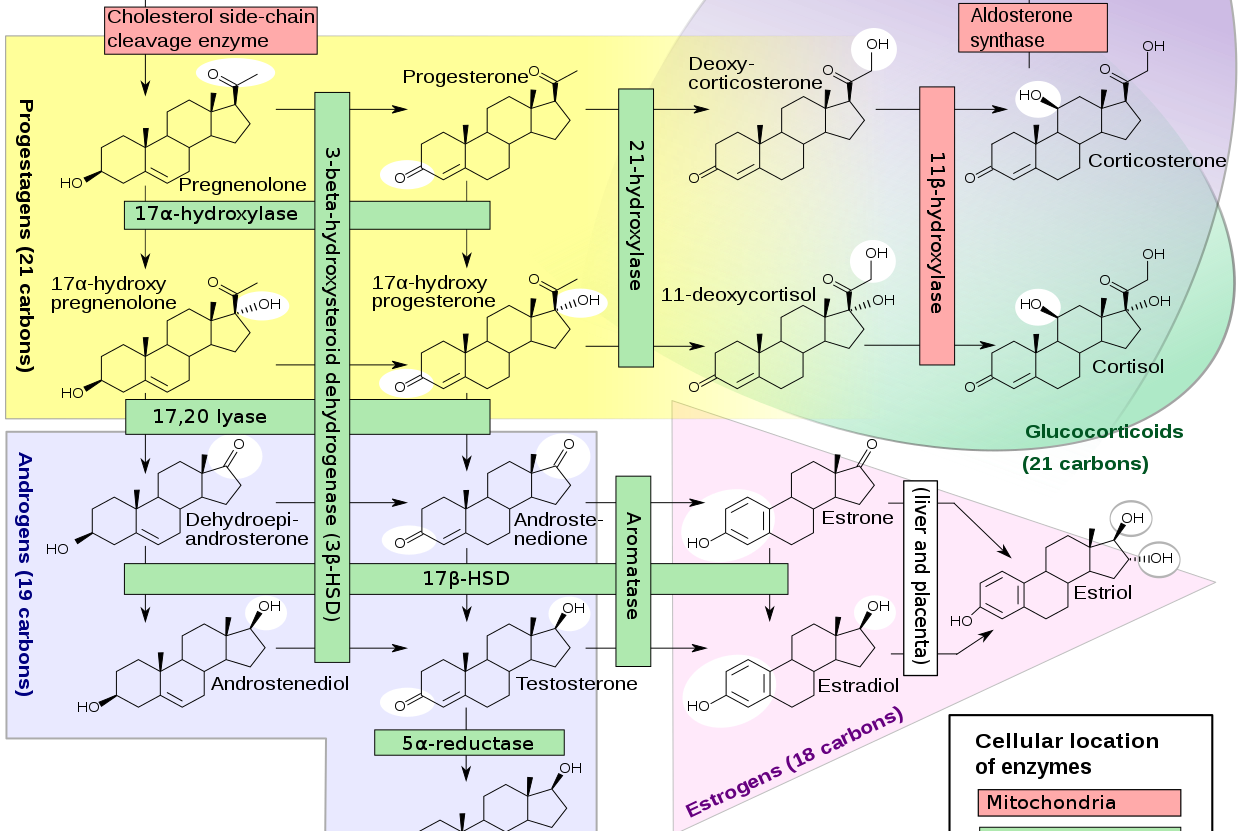
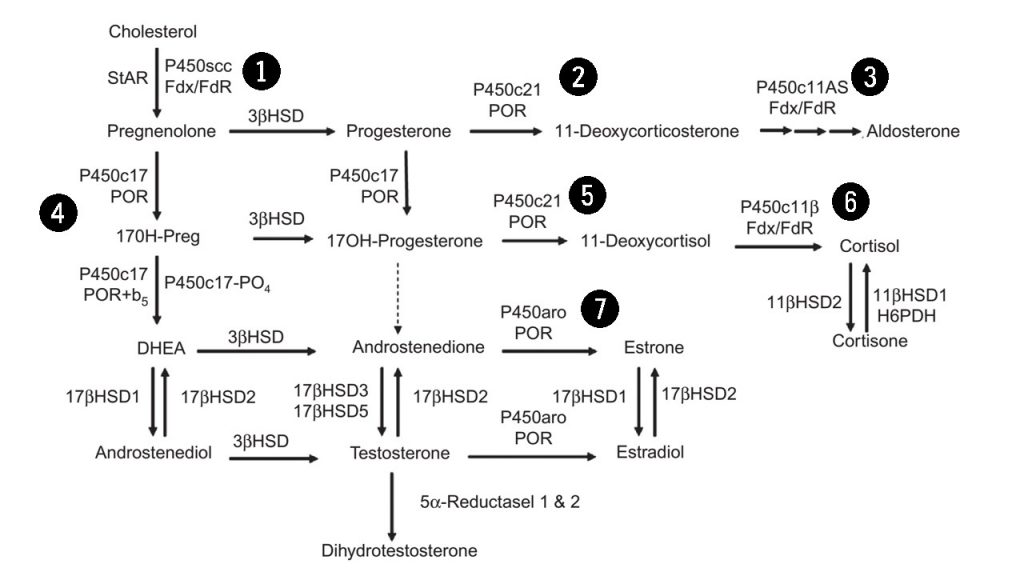
Sebanyak 7 enzim P450 terlibat dalam steroidogenesis (Gambar 3). Enzim P450 (CYP11A1) merupakan enzim yang terlibat dalam pembelahan rantai samping kolesterol. Enzim P450C11, P450c11β (11 β-hidroksilase; CYP11B1), dan P450c11AS (aldosteron sintase; CYP11B2), juga ditemukan pada mitokondria untuk mengkatalisis 11 β-hidroksilase, 18-hidroksilase, dan aktivitas 18-metil oksidase. P450c17 (CYP17A1 ditemukan pada retikulum endoplasma untuk mengkatalisis aktifitas 17 α-hidroksilase dan 17,20-lyase. P450c21 (CYP21A2) mengkatalisis 21-hidroksilase baik glukokortikoid maupun mineralokortikoid. Pada gonad dan lainnya, enzim P450aro (CYP19A1) pada retikulum endoplasma juga mengkatalisis aromatisasi androgen menjadi estrogen.
Enzym Hydroxysteroid Dehydrogenase
Enzim HSD tidak memiliki gugus heme dan memerlukan fosfat sebagai co-faktornya untuk mereduksi atau mengoksidasi steroid oleh dua elektron melalui transfer hibrida. Tidak seperti kebanyakan reaksi steroidogenik yang dikatalisis oleh enzim P450, setiap reaksi HSD dapat dikatalisis oleh setidaknya dua isozim yang berbeda. Isozim (juga dikenal sebagai isoenzim atau lebih umum sebagai berbagai bentuk enzim) adalah enzim yang berbeda dalam urutan asam amino tetapi mengkatalisis reaksi kimia yang sama. Yang termasuk kelompok enzim ini adalah 3α- dan 3βHSD, dua 11βHSD, dan rangkaian 17βHSD.
Enzim HSD dikategorikan dalam dua kelompok yaitu Short-chain Dehydrogenase Reductase (SDR) yang dikenal dengan rantainya yang pendek, adanya ‘lipatan Rossman’ (Lipatan Rossmann adalah lipatan tersier yang ditemukan dalam protein yang mengikat nukleotida, seperti kofaktor enzim FAD, NAD⁺, dan NADP⁺), dan golongan aldo-keto-reduktase (AKR), dengan adanya motif triosephosphate isomerase (TIM). Enzim SDR mencakup 11βHSDs 1 dan 2, dan 17βHSDs 1, 2, 3, dan 4. AKR enzim mencakup 17βHSD5 yang penting dalam aktivasi prekursor androgenik ekstra kelenjar dan 3αHSDs yang berperan dalam sintesis androgen janin. Berdasarkan aktivitas enzimnya, secara fisiologis lebih mudah mengelompokkan enzim ini kedalam enzim dehidrogenase atau reduktase. Dehidrogenase menggunakan NAD1 sebagai kofaktornya untuk mengoksidasi hidrosisteroid menjadi ketosteroid. Reduktase menggunakan NADPH untuk mereduksi ketosteroid menjadi hidroksisteroid. Meskipun enzim ini bisa bekerja dua arah secara in vitro, secara fisiologis, pada in vivo cenderung berfungsi satu arah dengan arah yang ditentukan oleh kofaktor intraseluler yang tersedia.
Biosintesis Hormon Steroid
Pengambilan, Penyimpanan, Pengangkutan dan Pengiriman Kolesterol ke Mitokondria
Sel Steroidogenik dapat mensintesis kolesterol baru dari asetat, tetapi sebagian besar suplay kolesterol berasal dari Low Density Lipoproteins (LDL) atau sering disebut oleh orang Indonesia sebagai kolesterol jahat, yang diperoleh dari makanan. Kolesterol intraseluler kemudian diregulasi oleh Sterol Response Element Binding Protein (SREBP), yang merupakan faktor transkripsi yang terlibat dalam biosintesis kolesterol dan asam lemak. Konsentrasi LDL yang cukup akan menekan HMG CoA Reduktase, enzim pembatas laju dalam sintesis kolesterol. Namun hormon ACTH (adenocorticotropic hormone) di adrenal dan LH (luteinizing hormone) yang bekerja melalui cAMP, akan merangsang HGM CoA reduktase dan reseptor LDL untuk mengambil kolesterol dari LDL. Kolesterol yang diambil disimpan secara langsung atau diubah menjadi kolesterol bebas untuk digunakan dalam biosintesis hormon steroid. Kolesterol bebas dapat diubah menjadi lipid dengan bantuan acyl-CoA (transferase kolesterol; ACAT) melalui mekanisme esterifikasi. Kolesterol diakses menggunakan protein NPC dan oleh HSL (hormone sensitive lipase). ACTH merangsang HSL dan menghambat ACAT sehingga meningkatkan ketersediaan kolesterol bebas untuk mensintesis hormon steroid. Kolesterol bebas yang tidak teresterifikasi berpindah ke mitokondria melalui mekanisme transport vesikuler yang melibatkan fusi membran atau transport non vesikuler dengan terikat pada protein START (transfer lipid related StAR) yang secara struktural terkait dengan regulasi akut steroidogenesis. StAR memainkan peran dalam pengangkutan kolesterol ke mitokondria tetapi berfungsi memindahkan kolesterol dari membran luar ke membran dalam mitokondria.
Steroidogenic Acute Regulatory Protein, StAR
Sementara sel-sel yang memproduksi hormon polipeptida dapat menyimpan hormon dalam vesikula sekretoris untuk digunakan sebagai respon terhadap perubahan potensial membran, sel steroidogenik menyimpan sangat sedikit steroid, sehingga permintaan steroid yang lebih banyak membutuhkan sintesis steroid yang cepat. ACTH yang merupakan produk proteolitik dari POMC (pro-opiomelanocortin) merupakan faktor trofik yang merangsang pertumbuhan adrenal melalui FGF (fibroblast growth factor), EGF (epidermal growth factor), dan IGF2 (insulin-like growth factor 2). ACTH juga faktor yang menstimulasi regulasi kronis dari steroidogenesis dengan cara menstimulasi transkripsi gen untuk enzim steroidogenik, terutama CYP11A1 yang mengkode P450scc. Induksi steroidogenesis yang cepat dimediasi untuk mengatur pergerakan kolesterol dari membran luar ke membran dalam mitokondria. Aliran kolesterol ini diatur oleh StAR yang kemudian mengatur steroidogenesis dengan cara mengatur akses substrat kolesterol.
Secara historis, ketika sel steroidogenik diberi perlakuan penghambat sintesis protein, respon steroidogenik akut menghilang, yang menunjukkan bahwa protein bekerja pada tingkat mitokondria sebagai pemicu spesifik untuk respon steroidogenik. Faktor ini diidentifikasi sebagai fosfoprotein 30- dan 37-kDA yang berumur pendek yang disintesis dengan cepat ketika sel steroidogenik distimulasi sehingga diberinama StAR (steroidogenic acute regulatory protein). Peran StAR dalam steroidogenesis dibuktikan dengan temuan bahwa mutasi StAR menyebabkan penyakit kelainan genetik pada kelenjar adrenal. Jadi, StAR adalah pemicu yang diperlukan agar kolesterol dapat bergerak dari membran luar ke membran dalam dengan cepat, sebagai respon untuk kortisol menjadi ACTH dan steroid seks menjadi LH.
P450scc
Langkah awal yang membatasi kecepatan dalam steroidogenesis adalah konversi kolesterol menjadi pregneolone (prekursor hormon yang diproduksi oleh kelenjar adrenal) oleh enzim cytochrome P450scc (dikode gen CYP11A1). Ekspresi enzim ini akan menyebabkan sel menjadi steroidogenik sehingga bertindak menjadi pengatur steroidogenesis jangka panjang. Enzim P450cc mengkatalisis tiga reaksi kimia yang berbeda yaitu 20α-hidroksilasi, 22-hidroksilasi, dan pemotongan rantai samping kolesterol untuk menghasilkan asam isocaproik dan pregnenolone. Tidak ada enzim lain yang dapat menghasilkan pregnenolone. Transkripsi gen CYP11A1 tunggal pada kromosom 15, diatur berbeda-beda pada jenis sel yang berbeda. Di zona adrenal fasciculata dan gonad, ACTH dan LH bekerja melalui cAMP menggunakan daerah promotor spesifikaktif cis, di zona gromerulosa adrenan, angiotensin II bekerja melalui jalurkalsium menggunakan cis yang berbeda walaupun memiliki promotor yang sama, tetapi pada kedua kasus, faktor steroidogenik-1 sangat penting. Sebaliknya, ekspresi plasenta CYP11A1, yang penting untuk sintesis progesteron plasenta, menekan kontraktilitas uterus sehingga dapat mempertahankan kehamilan. Karena progesteron plasenta sangat diperlukan untuk mempertahankan kehamilan, maka mutasi pada gen CYP11A1 menyebabkan hilangnya fungsi plasenta.
P450c17: 17 α -Hyd roxylase/17,20-lyase
Microsomal P450c17 mengkatalisis aktivitas 17α- hydroxylase dan 17,20-lyase di adrenal dan gonad, dan karenanya merupakan pengatur kualitatif utama proses steroidogenesis, yang menentukan kelas steroid mana yang akan diproduksi. Jika tidak terdapat P450c17, zona adrenal glomerulosa, granulosa ovarium, dan plasenta akan menghasilkan steroid 21-carbon (C21) 17-deoksi, seperti pada progesteron dan aldosteron. Tetapi jika terdapat aktivitas 17-hidroksilase, zona adrenal fasciculata menghasilkan C21 17-hydroxy steroid kortisol, dan jika terdapat aktivitas 17- hydroxylase dan 17,20-lyase, zona adrenal retikularis, sel teka ovarium, dan sel leydig testis memproduksi androgen 19-carbon (C19). Reaksi 17α-hidroksilase lebih mudah terjadi dibandingkan reaksi 17,20-lyase. Pregnenolone dan progesteron masing-masing dapat berubah dari 17α-hidroksilase menjadi 17OH-Preg dan 17OHP. 17OH-Preg juga dapat mengalami pemotongan ikatan karbon C17,20 untuk menghasilkan DHEA. Tetapi karena P450c17 manusia mengkatalisis konversi 17OHP menjadi androstenedion dengan hanya 3% dari laju konversi 17OH-Preg menjadi DHEA, reaksi ini dapat diabaikan dalam sintesis androgen manusia. 17OH-Preg dianggap sebagai substrat untuk aktivitas 17,20-lyase yang merupakan ciri primata tapi tidak pada mamalia lainnya, dan konsisten dengan sejumlah besar DHEA yang diproduksi pada adrenal primata. P450c17 produksi oleh gen CYP17A1, yang secara struktural juga terkait dengan gen CYP21A2 untuk P450C21 (21-hidroksilase). Seperti pada semua enzim P450 tipe 2, P450c17 terikat pada retikulum endoplasma halus dimana enzim ini memediasi katalisis dengan elektron NADPH yang disumbangkan oleh P450 oksidoreduktase. Jadi, perbedaan antara 17α-hidroksilase dan 17 , 20-lyase adalah fungsional dan bukan genetik atau struktural.
P450c21: Stero id 21-Hydroxylase
Mikrosomal P450c21 mengkatalisis 21-hidroksilasi progesteron menjadi deoksikortikosteron (DOC) dan 17OHP menjadi 11-deoksikortisol dalam biosintesis mineralokortikoid dan glukokortikoid. Sifat reaksi dari 21-hidroksilasi telah menjadi perhatian dalam dunia medis karena defisiensi 21-hidroksilase menyebabkan sekitar 95% dari semua kasus Congenital Adrenal Hyperplasia (CAH) dengan kejadian sektiar 1:15.000 kehaliran. Penurunan sintesis aldosteron dan kortisol dapat menyebabkan kolaps kardiovaskular dan kematian pada masa bayi jika tidak ditangani dengan tepat. Penurunan sintesis kortisol dalam rahim menyebabkan kelebihan produksi ACTH dan akibatnya stimulasi berlebihan dari sitnesis steroid adrenal janin. Oleh karena tahap 21-hidroksilase terganggu, 17OHP terakumulasi karena P450c17 hanya mengubah 17OHP menjadi androsenedion dalam jumlah yang sangat kecil. Namun 170HPreg juga terakumulasi dan secara efisien diubah menjadi DHE dan kemudian menjadi androstenedion dan testosteron, sehingg amengakibatkan virilisasi prenatal yang parah pada janin perempuan. P450c21 ditemukan pada retikulum endoplasma halus. Aktivitas 21-hidroksilase telah dijelaskan dalam berbagai jaringan ekstra-adrenal, tetapi 21-hidroksilasi ekstra-adrenal tidak dikatalisis oleh P450c21. 21-hidroksilasi pada hati dimediasi oleh beberapa enzim, terutapa yang dikodekan oleh CYP2C19 dan CYP3A4 yang secara prinsip terlibat dalam metabolisme obat. Dengan demikian, beberapa aktivitas 21-hidroksilase dapat diatur oleh pola perlakukan obat dan xenobiotik.
Isozymes P450c11: P450c11 β dan P450c11AS
Langkah terakhir dalam sintesis glukokortikoid dan mineralokortikoid dikatalisis oleh dua enzim yang terdapat pada mitokondria yaitu P450c11β dan P450c11AS. Kedua isozim ini memiliki 93% identitas urutan asam amino dan dikodekan oleh gen duplikat CYP11B1 dan CYP11B2. Kedua enzim ini ditemukan pada membran dalam mitokondria dan menggunakan ferredoxin dan ferredoxin reductase untuk menerima elektron dari NADPH untuk memediasi katalisis. Sejauh ini, isozim yang lebih melimpah adalah P450c11β, yang merupakan 11β-hidroksilase yang mengubah 11-deoksikortisol menjadi kortisol dan 11-deoksikortikosteron menjadi kortikosteron, tetapi hanya P450c11AS yang dapat mensintesis aldosteron dari 18OH-kortikosteron. Transkripsi gen CYP11B1 yang menyandi P450c11β diinduksi oleh ACTH melalui cAMP dan ditekan oleh glukokortikoid sedangkan transkripsi gen CYP11B2 yang menyandi P450c11AS diinduksi oleh kalium dan angiotensin melalui jalur protein kinase.
Isozyme s of 17 β -Hydroxys teroid Dehydrogena se (17 β HSD )
17β-hydroxysteroid dehydrogenases (17βHSD) sering disebut juga dengan 17-ketosteroid reduktase, yang mengubah androstenedion menjadi testosteron, DHEA menjadi androstenediol dan estron menjadi estradion. Terminologi untuk enzim ini bervariasi, tergantung pada arah reaksinya. 17βHSD1 yang dikodekan oleh HSD17B1 adalah enzim SDR reduktif sitosol yang bertama kali diisolasi dan di klon dari plasenta, dimana enzim ini menghasilkan estriol yang diekspresikan dalam sel granulosa ovarium. 17βHSD1 menggunakan NADPH sebagai co-faktor untuk mengkatalisis aktivitas reduktase. Sampai saat ini, tidak ada sindrom defisiensi genetik untuk 17βHSD1 yang telah dijelaskan.
17βHSD2 yang dikode oleh HSD17B2, merupakan oksidase microsomal yang menggunakan NAD1 untuk menonaktifkan estradiol menjadi estron dan testosteron menjadi androstenedion. 17βHSD2 ditemukan pada plasenta, hati, usus kecil, prostat, endrometrium sekretori, dan ovarium. Berbeda dengan 17βHSD1 yang ditemukan pada sel syncytiotrophoblast plasenta, 17βHSD2 diekspresikan dalam sel endotel dari pembuluh dara intravili plasenta secara konsisten dengan perannya yang nyata dalam mempertahankan sirkulasi janin dari bagian transplasental estradiol itu atau testosteron.Tidak ada sindrom defisiensi genetik untuk 17βHSD2 yang terjadi telah dilaporkan.
17βHSD3 yang dikodekan oleh HSD17B3 merupakan enzim mikrosom yang diekspresikan di dalam testis, dan merupakan bentuk androgenik utama dari 17βHSD. 17βHSD3 adalah enzim yang mengalami gangguan pada sindrom pseudohermaphroditism pada pria yang sering disebut akibat defisiensi 17-ketosteroid reduktase. 17βHSD4 awalnya diidentifikasi sebagai oksidase yang bergantung pada NAD1 dengan aktivitas yang mirip dengan 17βHSD2. Namun protein ini terletak pada peroksisom dan terutama merupakan enoyl-CoA hydratase dan 3-hydroxyacyl-CoA dehydrogenase. Defisiensi 17βHSD4 menyebabkan sindrom Zellweger, dimana biosintesis asam empedu terpengaruh tetapi steroidogenesis tidak. 17βHSD5 sering juga disebut dengan enzim AKR1C3. 17βHSD5 mengkatalisis reduksi androstenedion menjadi testosteron. Menariknya, 17βHSD5 lebih banyak diekspresikan dalam kelenjar adrenal janin manusia, selama waktu diferensiasi seksual dari pada 17βHSD3. Dengan demikian, ia dapat berpartisipasi dalam produksi testosteron adrenal. Zona adrenal retikularis postnatal juga mengekspresikan 17βHSD5 pada tingkat yang rendah, terhitung untuk sejumlah kecil testosteron yang diproduksi oleh kelenjar adrenal.
P450aro: Aromatase
Estrogen diproduksi oleh proses aromatisasi androgen, termasuk yang diproduksi di kelenjar adrenal oleh serangkaian reaksi kompleks yang dikatalisis oleh aromatase mikrosomal tunggal P450aro. Mikrosomal P450aro ini dikode oleh gen CYP19A1. Ekspresi aromatase dalam jaringan “ekstraglandular” terutama jaringan adiposa, dapat mengubah androgen adrenal menjadi ekstrogen dan ekspresi aromatase dalam epifisis tulang yang sedang tumbuh mengubah testosteron menjadi estradiol. Pria dengan defisiensi aromatase memiliki perawakan tinggi, pematangan epifisis yang tertunda dan osteopenia yang dengan cepat dibalik oleh pergantian estrogen, yang menunjukkan bahwa estrogen, bukan testosteron, yang terutama bertanggung jawab atas pematangan epifisis. Meskipun estrogen pernah dianggap perlu untuk perkembangan embrionik dan janin, janin dengan lesi genetik pada CYP19A1 tidak dapat memproduksi estrogen dan jadin yang mengalami lesi genetik pada CYP11A1 tidak dapat menghasilkan steroid, memiliki perkembangan janin yang normal dan proses kelahiran yang normal.
Isozyme s of 5 α -Reductase
Testosteron dikonversi menjadi androgen dihydrotestosteron (DHT) yang lebih kuat dengan dua bentuk 5α-reduktase. Enzim tipe 1 yang dikodekan oleh gen SRD5A1 ditemukan pada kulit kepala dan jaringan perifer, sedangkan enzim tipe 2 dikodekan oleh gen SRD5A2 merupakan bentuk dominan yang ditemukan pada jaringan reproduksi pria. Mutasi pada gen SRD5A2 menyebabkan defisiensi 5α-reduktase, suatu kelainan diferensiasi seksual pada pria yang memiliki variasi fenotip yang luas, tergantung pada penyebabnya. 5α-reduktase menunjukkan pola regulasi perkembangan yang berbeda. Gen tipe-1 tidak diekspresikan secara luas dalam darah, tetapi diekspresikan dalam testis janin, dimana gen tersebut berperan dalam jalur alternatif sintesis androgen, kemudian diekspresikan secara singkat pada kulit bayi yang baru lair dan kemudian tidak terlihat pada saat mencapai pubertas. Gen tipe-2 diekspresikan dalam kulit genital janin dimana gen tersebut berpartisipasi dalam diferensiasi seksual pria normal dan juga diekspresikan dalam sel prostat dewasa dan sel adenokasinoma prostat. Dengan demikian enzim tipe-1 mungkin bertanggung jawab atas virilisasi pubertas yang terlihat pada pasien dengan defisiensi 5α-reduktase, dan enzim tipe-2 mungkin terlibat pada kebotakan pada pria.
Isozymes of 11 β -Hydroxysteroid Dehydrogenase (11βHSD)
Meskipun steroid tertentu bisa dikategorikan sebagai glukokortikoid aau mineralokortikoid, reseptor ‘mineralokortikoid’ (glukokortikoid tipe 2) memiliki afinitas yang sama untuk aldosteron dan kortisol. Namun karena jaringan yang responsif, mineralokortikoid mengubah kortisol menjadi kortison yang tidak berikatan dengan reseptor, dan kortisol tidak bertindak sebagai mineralokortikoid secara in vivo. Interkonversi kortisol dan kortison dimediasi oleh dua isozim 11β-hydroxysteroid dehydrogenase (11βHSD). Kedua isozim dapat mengkatalisasi aktivitas oksidase dan reduktase, bergantung pada faktor samping yang tersedia (NADP1 atau NADPH masing-masing).
Enzim Tipe-1 11βHSD1 dikodekan oleh gen HSD11B1, diekspresikan terutama pada jaringan yang responsif terhadap glukokortikoid seperti hati, testis, paru-paru, dan tubulus proximal. 11βHSD1 terletak pada sisi luminal retikulum endoplasma dan tidak bersentuhan dengan sitoplasma. 11βHSD1 dapat mengkatalisasi oksidasi kortisol menjadi kortison menggunakan NADP1 sebagai co-faktornya atau reduksi kortison menjadi kortisol menggunakan NADPH sebagai co-faktornya. Arah reaksi tergantung pada co-faktor yang tersedia, tetapi 11βHSD1 hanya berfungsi dengan steroid konsentrasi tinggi. Sebaliknya, 11βHSD2 dikodekan oleh gen HSD11B2, yang hanya mengkatalisis oksidasi kortisol menjadi kortison menggunakan NADH dan dapat berfungsi pada steroid dengan konsentrasi rendah. 11βHSD2 diekspresikan pada jaringan yang responsif terhadap mineralokortikoid dand engan demikian memiliki fungsi mempertahankan reseptor mineralokortikoid dengan cara menonaktifkan kortisol menjadi kortison. Jadi 11βHSD2 mencegak kortisol dari reseptor mineralokortikoid ginjal yang berlebihan dan menonaktifkan kortisol di plasenta dan jaringan janin lainnya.
Isozymes of 3α-Hydroxysteroid Dehydrogenase (3αHSD)
Empat 3α-hydroxysteroid dehydrogenases (3αHSDs) utama pada manusia adalah enzim AKR dari golongan AKR1C yaitu 3α HSD tipe 1, 2, 3, dan 4, juga masing-masing disebut juga dengan AKR1C4, 1C3, 1C2, and 1C1. Enzim-enzim ini secara struktural sangat mirip dan mengkatalisasi beragam konversi steroid dan reaksi lainnya. 3αHSD merupakan konstituen penting dari apa yang disebut ‘jalur belakang’ steroidogenesis. Jalur yang luar biasa ini ditemukan dalam studi steroidogenesis pada testis janin marsupial, memainkan peranan sentral dalam diferensiasi seksual pria. Pada jalur ini, 17OHP diubah menjadi DHT tanpa melalui DHEA, androstenedion atau testosteron dan karenanya memberikan mekanisme dimana 17OHP dapat berkontribusi pada virilisasi janin perempuan pada kondisi defisiensi 21-hidroksilase. Aktivitas 3αHSD reduktif dan oksidatif. Aktifitas reduktif dikatalisis oleh AKR1C2 (3αHSD3) atau AKR1C4 (3αHSD1), tetapi sifat enzim oksidatif tidak pasti. AKR1C3 (3αHSD2) yang mengubah androstenedion menjadi testosteron di adrenal juga dikenal sebagai 17βHSD5.
Steroid Sulfotransferase and Sulfatase
Steroid sulfat dapat disintesis langsung dari kolesterol sulfat atau dibentuk melalui sulfasi steroid yang ada oleh enzim cytosolic sulfotransferase (SULT). Setidaknya terdapat 44 jenis isoform berbeda dari enzim ini yang telah teridentifikasi ke dalam 5 kelompok gen SULT. Banyak dari gen ini menghasilkan produk yang saling bersambungan untuk menghasilkan sejumlah besar enzim dan donor sulfat wajib untuk semua enzim SULT adalah 3 0-phosphoadenosine-5 0-phosphosulfate (PAPS). Enzim SULT yang mensulfonasi steroit termasuk SULT1E (yang mensulfatasi estrogen), SULT2A1 (yang mensulfatasi steroit nonaromatik), dan SULT2B1 (yang mensulfatasi sterol). SULT2A1 adalah enzim SULT utama yang diekspresikan dalam kelenjar adrenal di mana ia mensulfatasi gugus 3β-hydroxyl dari Δ5 steroids (pregnenolone, 17OH-pregnenolone, DHEA, dan androsterone) tetapi tidak dari kolesterol. SULT2B1a juga akan mensulfonasi pregnenolone tetapi tidak untuk kolesterol; alternatifnya, kolesterol merupakan substrat utama untuk SULT2B1b di kulit, hati dan di tempat lain. Apakah steroid sulfat hanyalah bentuk steroid yang tidak aktif atau apakah mereka melayani peran hormonal tertentu masih belum jelas.
Kerusakan gen SULT1E1 pada tikus menyebabkan peningkatan kadar estrogen, peningkatan faktor ekspresi jaringan di plasenta dan peningkatan aktivasi trombosit yang menyebabkan trombi plasenta dan kehilangan janin. Mutasi yang menghilangkan enzim SULT pada manusia belum dapat dijelaskan, tetapi beberapa polimorfisme nukleotida tunggal yang mengubah urutan asam amino dan aktivitas katalitik mempengaruhi aktifitas obat. Orang Afrika-Amerika memiliki tingkat polimorfisme SULT2A1 yang tinggi sehingga mempengaruhi rasio plasma DHEA yang berkorelasi dengan resiko kanker prostat dan kanker lainnya.
Steroid sulfat juga dapat dihidrolisis menjadi steroid asli dengan steroid sulfatase. Fakta bahwa pria memiliki satu salinan gen ini juga memungkinkan menyebabkan tingkat DHEA yang lebih tinggi pada pria dibandingkan perempuan pada usia yang sama. Dalam adrenal dan plasenta janin, defisiensi sulfatase yang berkurang atau tidak ada mengurangi kumpulan DHEA bebas yang tersedia untuk konversi plasenta menjadi estrogen.
Referensi
Bremer, A. A., & Miller, W. L. (2014). Regulation of steroidogenesis. In Cellular endocrinology in health and disease (pp. 207-227). Academic Press.