Berbagai Metode Awetan Jaringan Tumbuhan
Mikroteknik tumbuhan merupakan teknik pembuatan sediaan awetan bagian tumbuhan atau keseluruhan tubuhan yang bertujuan untuk mempermudah pengamatan dengan atau tanpa mikroskop. Sediaan harus terawetkan hingga tingkatan sel sehingga dapat disimpan dalam kurun waktu yang lama. Untuk preparat yang akan diamati menggunakan mikroskop, sediaan harus cukup kecil dan tipis sehigga dapat ditembus oleh cahaya. Untuk memperoleh sediaan awetan tumbuhan, terdapat berbagai metode cara pembuatannya. Banyak tumbuhan yang telah diawetkan kemudian mengalami kerusakan akibat jaringannya belum terawetkan. Proses pembuatan sediaan mikroskopis merupakan pekerjaan yang memerlukan ketelitian, kemampuan tinggi, serta ditunjang dengan kemampuan dan minat oleh masing-masing individu. Proses dalam pembuatan suatu sediaan histologi secara umum melalui beberapa tahapan penting, tertangung jenis sediaan yang mau dibuat.
Herbarium
Herbarium merupakan awetan tanaman dengan metode pengeringan untuk keperluan studi dalam biologi. Herbarium juga dapat diartikan sebagai herba yang dikeringkan dan merupakan kumpulan spesies tanaman yang dilengkapi dengan identitas spesies tanaman tersebut meliputi tempat hidup, warna daun, kerapatan tanaman, bau tanaman, dan informasi lainnya. Herbarium disimpan dalam gudang spesimen tumbuhan yang dipasang dalam lembaran kertas buatan tangan. Herbarium diatur dalam sistem klasifikasi yang dikenali berdasarkan kekerabatan tumbuhan dan disimpan dalam wadah besi serta dirawat dengan sangat berhati-hati untuk pengamatan dimasa yang akan datang. Herbarium juga dijadikan sebagai bahan referensi untuk penamaan, identifikasi, dan klasifikasi tumbuhan. Herbarium diindeks dengan kode yang unik dalam “Index Herbariorum” yang saat ini ditetapkan dan dikelola oleh New York Botanical Garden Herbarium.
Tidak semua herbarium merupakan herbarium kering dan ditempelkan pada kertas spesimen, terdapat pula herbarium yang disimpan dalam keadaan basah. Secara umum terdapat dua jenis herbarium, yaitu herbarium kering dan herbarium basah. Kelebihan herbarium kering dibandingkan herbarium basah adalah dapat bertahan lama hingga ratusan tahun. Terdapat beberapa kelemahan pada herbarium yaitu spesimen mudah mengalami kerusakan akibat perawatan yang kurang memadai maupun karena frekuensi pemakaian yang cukup tinggi untuk identifikasi dan pengecekan data secara manual, tidak bisa diakses secara bersama-sama oleh berberapa orang, tidak bisa diakses sewaktu-waktu dan tidak dapat diakses dari jarak jauh. Herbarium kering yang baik adalah herbarium yang disajikan dengan lengkap organ vegetatif dan organ generatifnya. Selain itu, kerapian dan keteraturan penyusunan spesimen pada kertas spesimen juga menentukan nilai estetikanya. Selain itu faktor yang ikut mempengaruhi herbarium adalah lama pembuatannya, tempat penyimpanan, serta faktor lingkungan dimana herbarium digunakan dan disimpan.




Irisan Jaringan Tumbuhan
Metode irisan jaringan tumbuhan merupakan metode yang digunakan untuk mengamati jaringan tumbuhan dengan cara melakukan irisan pada organ tertentu, bergantung pada tujuan pengamatan, lalu dipreparasi menggunakan objek glass dan diamati menggunakan mikroskop. Preparasi sampel pada metode irisan jaringan tumbuhan dibagi menjadi 3 yaitu temporary preparation, semitemporary preparation, dan permanent preparation.
Temporary Preparation
Temporary preparation adalah preparasi jaringan untuk pengamatan sementara. Biasanya preparat tidak bertahan lama dan hanya diamati sementara saja karena reagen yang digunakan tidak untuk mengawetkan jaringan. Biasanya sampel diberi tambahan air dan diletakkan pada slide kaca bersih, lalu kemudian ditutup menggunakan cover slide. Biasanya preparat ini harus segera diamati dibawah mikroskop karena penguapan air yang cukup cepat. Untuk mencegah penguapan, biasanya pada pinggiran slide diberi gliserin atau petrolium jelly.
Semi Temporary Preparation
Semi Temporary Preparation artinya preparasi sampel dilakukan agar sampel yang dihasilkan dapat bertahan pada jangka waktu tertentu. Biasanya menggunakan gliserin dalam preparat, tetapi dapat juga menggunakan asam laktat dan fenol, terutama dalam preparasi alga, fungi, dan paki-pakuan serta bagian tipis dari spesimen tanaman kecil dimana penggunaan konsentrasi cairan tertentu terasuk laktofenol, fenol-gliserin, dan gliserin-jelly.
Permanent Preparation
Permanent preparasi memungkinkan preparat dapat disimpan dalam jangka waktu yang sangat lama sehingga dapat diamati berulang-ulang. Hal ini memungkinkan untuk sebagian kecil jaringan tumbuhan, organ tumbuhan atau tumbuhan utuh untuk tumbuhan dengan ukuran kecil. Sampel yang besar tidak dapat dipasang pada slide untuk pemeriksaan mikroskop. Preparasi sampel secara permanen mempertahankan bentuk dan strukturnya selama beberapa tahun. Preparasi sampel tanaman secara permanen dan pewarnaan yang permanen lebih baik daripada sampel yang disiapkan untuk sementara. Preparat permanen umumnya menggunakan metode parafin seperti pada pembuatan preparat jaringan hewan.

Pengamatan Kromosom Mitosis dengan Metode Squash
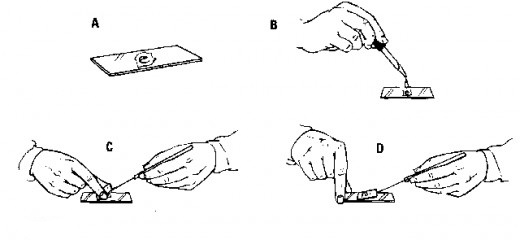
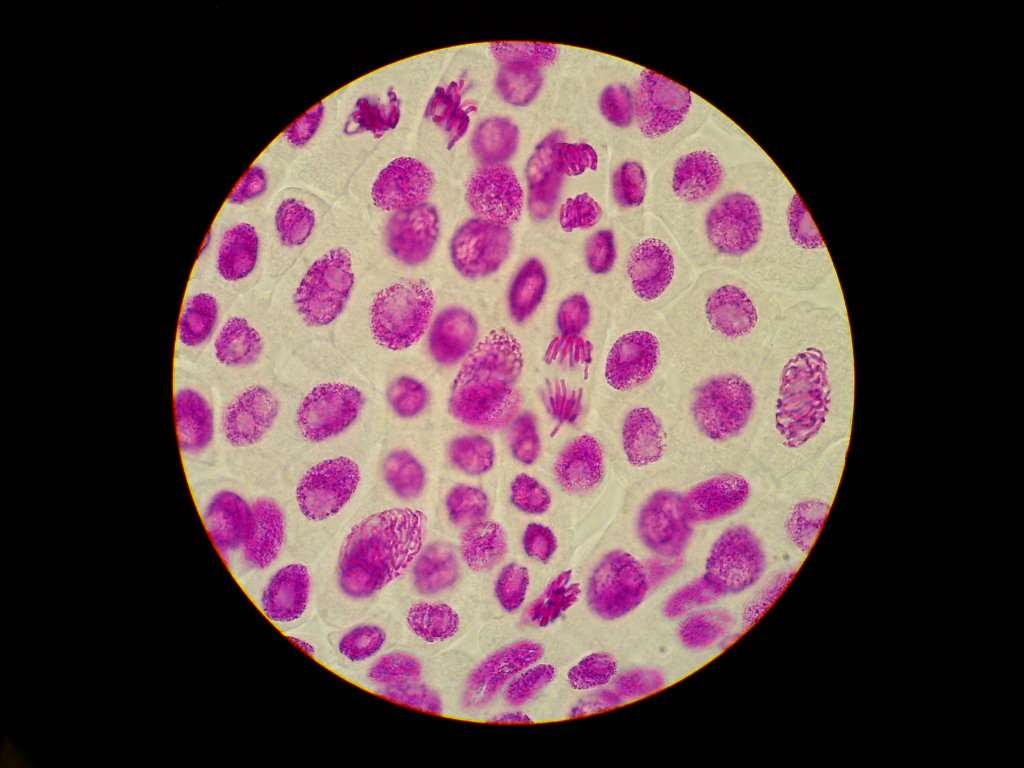
Preparat pencetan atau squash preparation adalah preparat yang dibuat dengan carea memencet sebuah objek diatas gelas benda dengan menggunakan karet pensil atau benda lainnya sehingga sel dari jaringan dapat terpisah dan dapat diamati lebih detail. Preparat squash ini biasanya digunakan untuk mengamati proses pembelahan motisis pada akar bawang atau pada jaringan lainnya. Prinsip kerja dari metode squash ini biasanya diawali dengan penanaman tumbuhan yang akan diamati dengan media air lalu dipreparasi sedemikian rupa. Preparasi sampel harus dilakukan pada saat terjadinya pembelahan mitosis sehingga pada waktu fiksasi, keadaan mitosis dapat tetap dan dapat diamati. Contohnya pada bawang merah, biasanya pembelahan mitosis terjadi pada pukup 06.00 – 08.00. Salah satu larutan yang digunakan untuk fiksasi jaringan adalah larutan asam asetat, lalu dilanjutkan dengan hidrolisis menggunakan HCl. HCl bertujuan melepaskan ikatan antar sel yang diikat oleh lamela tengah sehingga pada waktu di pencet, antar sel dapat terpisah dengan baik. Untuk proses pewarnaan sangat bergantung dari tujuan pengamatan. Jika pengamatan dilakukan untuk melihat kromosom, biasanya sebelum dipencet, jaringan direndam dalam larutan pewarna aceto-orcein atau aceto-carmin.
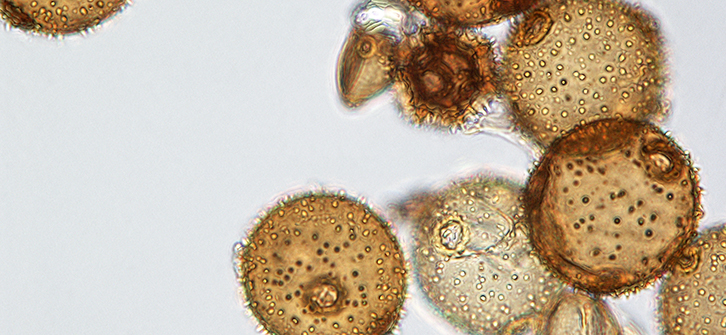
Preparasi Polen dengan Metode Asetolisis
Pollen merupakan gametofit jantan pada tumbuhan Gymnospermae dan Angiospermae, sedangkan spora biasanya dihasilkan tumbuhan non vaskuler seperti alga, jamur, lumut serta tumbuhan vaskuler tingkat rendah yaitu paku-pakuan. Metode yang biasa digunakan dalam mengamati preparat pollen ialah dengan metode asetolisis. Asetolisis adalah salah satu metode pembuatan preparat serbuk sari yang menggunakan prinsip melisiskan dinding sel serbuk sari dengan asam asetat glasial serta asam sulfat pekat sebagai bahan kimia fiksatif. Hal ini bertujuan untuk mendapatkan hasil pengamatan morfologi dinding serbuk sari ornamentasi dari serbuk sari tersebut. Serbuk sari yang digunakan dalam pembuatan preparat haruslah merupakan serbuk sari yang matang. Serbuk sari yang matang dapat ditandai dengan sudah tidak ada air dalam serbuk sari tersebut, jika serbuk sari dipatahkan maka hanya akan seperti tepung saja. Langkah-langkah dari proses asetolisis ini antara lain adalah fiksasi, pemanasan, pencucian, pewarnaan (staining), penutupan (mounting), dan labelling.
Penambahan H2SO4 dan asam asetat glasial dengan perbandingan 1:9 selama proses asetolisis ini berfungsi untuk untuk melisiskan selulosa pada dinding serbuk sari (asetolisis), sehingga setelah dibuat preparat, morfologi exine serbuk sari akan terlihat lebih jelas dibandingkan dengan sebelum asetolisis. Selain itu, asetolisis ini juga berfungsi seperti proses fiksasi, yaitu memelihara atau mempertahankan struktur dari serbuk sari. Langkah selanjutnya adalah melakukan sentrifuge untuk mendapatkan serbuk sari yang telah terasetolisis, memisahkannya dari larutan asam asetat glasial dan H2SO4 pekat. Hasil sentrifuge adalah supernatan di bagian atas tabung sentrifuge, yaitu larutan asam asetat glasial dan asam sulfat pekat serta endapan di dasar tabung, yaitu serbuk sari yang telah terasetolisis. Polen kemudian diamati dibawah mikroskop.
Preparat Whole Mount Tumbuhan
Whole mount merupakan metode yang digunakan dalam membuat preparat secara utuh. Preparat utuh bermakna preparat yang digunakan adalah preparat dari obyek secara utuh tanpa adanya pemotongan terhadap obyek. Obyek tersebut dapat berupa sel, jaringan, organ maupun tubuh suatu organisme namun tentunya organisme yang sangat kecil. Metode whole mount merupakan metode pembuatan preparat yang nantinya akan diamati dengan mikroskop tanpa didahului adanya proses pemotongan. Pada metode ini preparat yang diamati adalah preparat yang utuh, baik berupa sel, jaringan, organ maupun individu. Gambar yang dihasilkan oleh preparat whole mount terlihat dalam bentuk utuhnya sebagaimana pada waktu organisme tersebut masih hidup. Metode ini termasuk metode pembuatan preparat yang digunakan untuk pengamatan secara menyeluruh, artinya mempelajari struktur vegetatif dan reproduktifnya tanpa melakukan penyayatan terhadap tumbuhan karena semua bagian tumbuhan digunakan sebagai preparatnya. Tumbuhan yang diamati haruslah berukuran kecil sehingga dapat termuat pada object glass. Sedangkan pada tumbuhan yang agak besar bisa dilakukan pemotongan cabang agar lebih rapi. Metode whole mount mempunyai kelebihan dan kelemahan. Kelebihan metode ini adalah dapat mengamati seluruh bagian tumbuhan dengan jelas pada tiap bagian-bagiannya. Sedangkan kelemahannya adalah metode ini hanya bisa dilakukan pada tumbuhan dengan ukuran yang kecil.

Awetan Basah
Pada awetan basah, sampel tanaman membutuhkan perlakuan awal dengan larutan fiksatif sebelum disajikan. Ketika bagian tanaman dipisahkan dari tumbuhan utama, jaringannya akan mulai membusuk dan mengering karena kehilangan kelembaban karena terpapar udara, terinfeksi mikroorganisme terutama jamur dan bakteri, dan sel mendigestif dirinya sendiri dengan mengaktifkan enzim endonuklease. Untuk mengatasi hal tersebut, sampel tanaman dapat langsung diletakkan pada wadah kaca dan diberi larutan pengawet agar jaringan terfiksasi. Tanaman yang disimpan dalam wadah kaca dengan larutan fiksasi tersebut dapat bertahan dalam jangka waktu yang cukup lama. Umumnya larutan fiksatif yang digunakan dalam pengawetan ini berupa minyak khusus. Tetapi di herbarium bogoriense, koleksi herbarium basah diawetkan dengan menggunakan alkohol 70%. Selain hanya untuk penyimpanan, herbarium basah juga dapat disajikan dengan estetika seni yang menarik, sehingga memiliki nilai jual.




