Klasifikasi Protein Berdasarkan Struktur dan Fungsi
Protein Dibangun dari Susunan 20 Asam Amino
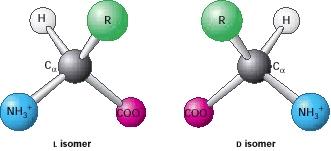
Asam amino merupakan monomer atau blok bangunan dari protein. Alfa asam amino dari atom karbon pusat yang disebut dengan karbon Alfa, terkait dengan gugus amino, gugus asam karboksilat, atom hidrogen, dan gugus R yang yang khas terdapat pada protein. Gugus R sering disebut sebagai rantai samping. Dengan empat kelompok berbeda yang terhubung ke Alfa-atom karbon tetrahedral, Alfa asam amino bersifat kiral artinya dua bentuk seperti cermin yang disebut dengan isomer I dan isomer d. Hanya isomer I asam amino yang merupakan penyusun protein. Untuk hampir semua asam amino, isomer I memiliki konfigurasi Absolute S dan bukan R. Meskipun banyak upaya yang telah dilakukan untuk memahami mengapa asam amino dalam protein memiliki konfigurasi Absolut ini, tidak ada penjelasan yang memuaskan yang dapat diperoleh. Tampaknya masuk akal bahwa pemilihan isomer I di atas d telah dipilih dan ditetapkan sejak awal sejarah evolusi.
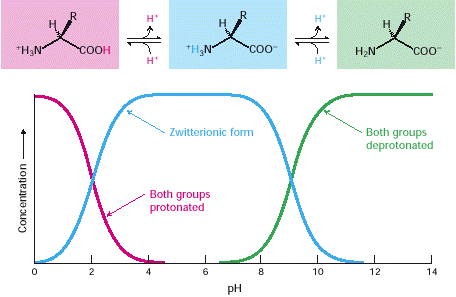
Asam amino merupakan larutan pada pH netral terutama sebagai ion dipolar yang juga disebut dengan zwitterion. Dalam bentuk dipolar, gugus amino terprotonasi (-NH3 +) dan gugus karboksil ter deprotonasi (-COO-). Keadaan ionisasi asam amino variasi dengan PH. Dalam larutan asam gugus amino ter protonasi dan gugus karboksil tidak terdisosiasi. Ketika PH dinaikkan, asam karboksilat adalah gugus pertama yang melepaskan Proton. Bentuk dipolar bertahan sampai PH mendekati 9 ketika gugus amino yang terprotonasi kehilangan 1 Proton.
Dua Puluh (20) jenis rantai samping yang bervariasi dalam ukuran bentuk, muatan, kapasitas ikatan hidrogen, karakter hidrofobik dan reaktivitas kimia umumnya ditemukan dalam protein. Memang, semua protein di semua spesies bakteri archaea dan eukariotik dibangun dari kumpulan 20 asam amino yang sama. Alfabet dasar protein ini berumur beberapa miliar tahun. Rentang fungsi yang luar biasa yang dimiliki oleh protein dihasilkan dari keragaman dan kesebergunaan an dari 20 jenis asam amino ini. Memahami bagaimana asam amino ini dapat digunakan untuk menciptakan struktur tiga dimensi yang rumit yang memungkinkan protein melakukan begitu banyak proses biologis adalah topik yang selalu menarik dan salah satu yang akan selalu dikaji dibidang molekular.
Mari kita lihat rangkaian asam amino ini. Yang paling sederhana adalah glisin, yang hanya memiliki atom hidrogen sebagai rantai sampingnya. Dengan dua atom hidrogen yang terikat pada atom Alfa karbonnya, glisin unik karena bersifat akiral. Alanin asam amino yang paling sederhana berikutnya, memiliki gugus metil (-CH3) sebagai rantai sampingnya.
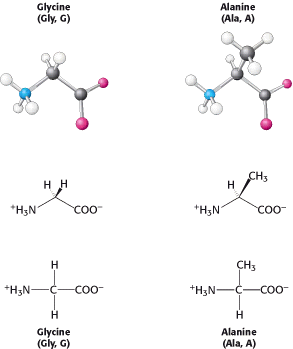
Rantai samping hidrokarbon yang lebih besar ditemukan pada Valin, lusin, dan isoleusin. Metionin mengandung sebagian besar rantai samping alifatik yang mencakup gugus tioeter (-S-). Rantai samping isoleusin mencakup pusat kirel tambahan, hanya isomer yang ditunjukkan an1 pada gambar yang ditemukan pada protein. Rantai samping alifatik yang lebih besar bersifat hidrofobik ya itu cenderung mengelompok bersama daripada kontak air. Struktur tiga dimensi dari protein yang larut dalam air distabilkan oleh kecenderungan kelompok hidrofobik untuk bersatu, yang disebut dengan efek hidrofobik. Ukuran dan bentuk yang berbeda-beda dari rantai samping hidrokarbon ini memungkinkan protein untuk berkemas bersama untuk membentuk struktur kompak dengan sedikit ruang. Asam amino prolin juga memiliki rantai samping alifatik tetapi berbeda dari anggota lain dari 20 asam amino karena rantai sampingnya terikat pada atom nitrogen dan alfa karbon. Protein sangat mempengaruhi arsitektur protein karena struktur cucinya membuatnya lebih dibatasi secara konformasi daripada asam amino lainnya.
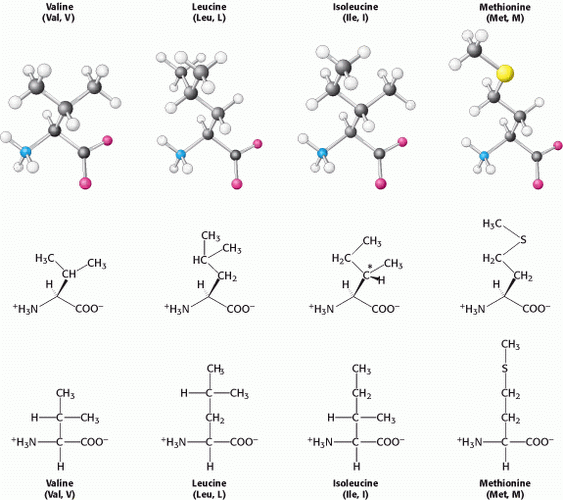
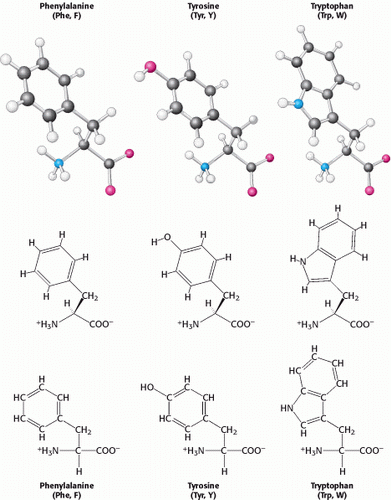
Tiga (3) asam amino dengan rantai samping aromatik yang relatif sederhana merupakan bagian dari struktur fundamental protein. Fenilalanin, mengandung cincin fenil yang melekat pada salah satu hidrogen alanin. Cincin aromatik tirosin mengandung gugus hidroksil. Gugus hidroksil ini cenderung reaktif, berbeda dengan rantai samping yang agak lembam dari asam amino lain. Triptofan memiliki cincin Indol yang bergabung dengan gugus metilen (-CH2-); kelompok indoor terdiri dari dua cincin penyatu dan kelompok NH. Fenilalanin murni hidrofobik, sedangkan tirosin dan triptofan kurang hidrofobik karena gugus hidroksil dan NH-nya. Cincin aromatik triptofan dan tirosin mengandung elektron p yang sangat menyerap sinar ultraviolet.
Dua asam amino, Serin dan treonin, mengandung gugus hidroksil alifatik. Sherin dapat dianggap sebagai versi hidroksilasi dari alanin, sedangkan treonin menyerupai Valin dengan gugus hidroksil menggantikan salah satu gugus metil Valin. Gugus hidroksil pada Serin dan treonin membuatnya lebih hidrofilik dan reaktif daripada alanin dan Valin. Trio Nin, seperti isoleusin, mengandung pusat asimetris tambahan di mana hanya satu isomer yang hadir dalam protein.
Sistein secara struktural mirip dengan Serin tetapi mengandung gugus sulfhidril atau tiol (-SH), menggantikan gugus hidroksil (-OH). Gugus sulfhidril jauh lebih reaktif. Pasangan gugus sulfhidril dapat bergabung untuk membentuk ikatan disulfida yang sangat penting dalam menstabilkan beberapa protein.
Selain itu juga terdapat beberapa asam amino dengan rantai samping yang sangat polar yang membuat asam amino tersebut sangat hidrofilik. Lisin dan arginin memiliki rantai samping yang relatif panjang yang berakhir dengan gugus yang bermuatan positif pada pH netral. Lisin dibatasi oleh gugus amino primer dan arginin oleh gugus guanidinium. Histidin mengandung gugus imidazol sebuah cincin aromatik yang juga dapat bermuatan positif. Sering ditemukan di situs aktif enzim, di mana cincin imidazol Dapat mengikat dan melepaskan Proton dalam reaksi enzimatik.
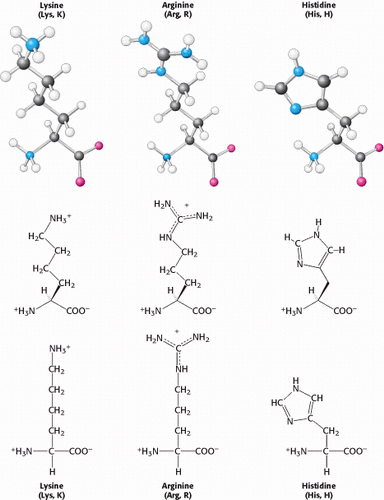
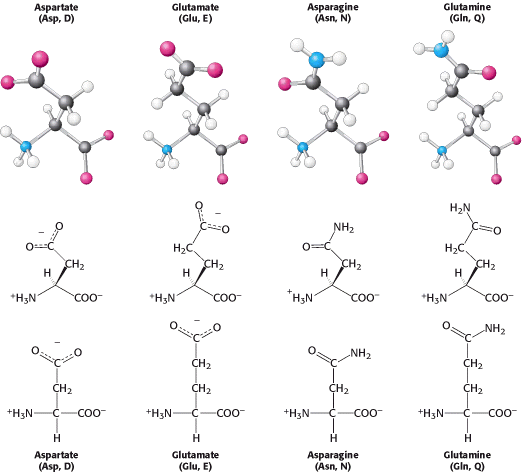
Himpunan asam amino juga mengandung 2 dengan rantai samping asam yaitu asam aspartat dan asam glutamat. Ini sering disebut aspartat dan glutamat untuk menekankan bahwa rantai samping ya biasanya bermuatan negatif pada pH fisiologis. Meskipun demikian, pada beberapa protein rantai samping ini menerima Proton, dan kemampuan ini seringkali penting secara fungsional. Selain itu, struktur tersebut mencakup turunan tak bermuatan dari aspartat dan glutamat asparagin dan glutamin yang masing-masing mengandung karboksamida Terminal sebagai pengganti asam karboksilat.
Tujuh dari 20 asam amino memiliki rantai samping yang mudah terionisasi. 7 asam amino ini mampu menyumbangkan atau menerima Proton untuk memfasilitasi reaksi serta membentuk ikatan ionik. Dua gugus lain dalam protein, gugus Alfa amino Terminal dan gugus Alfa karboksil Terminal dapat terionisasi.
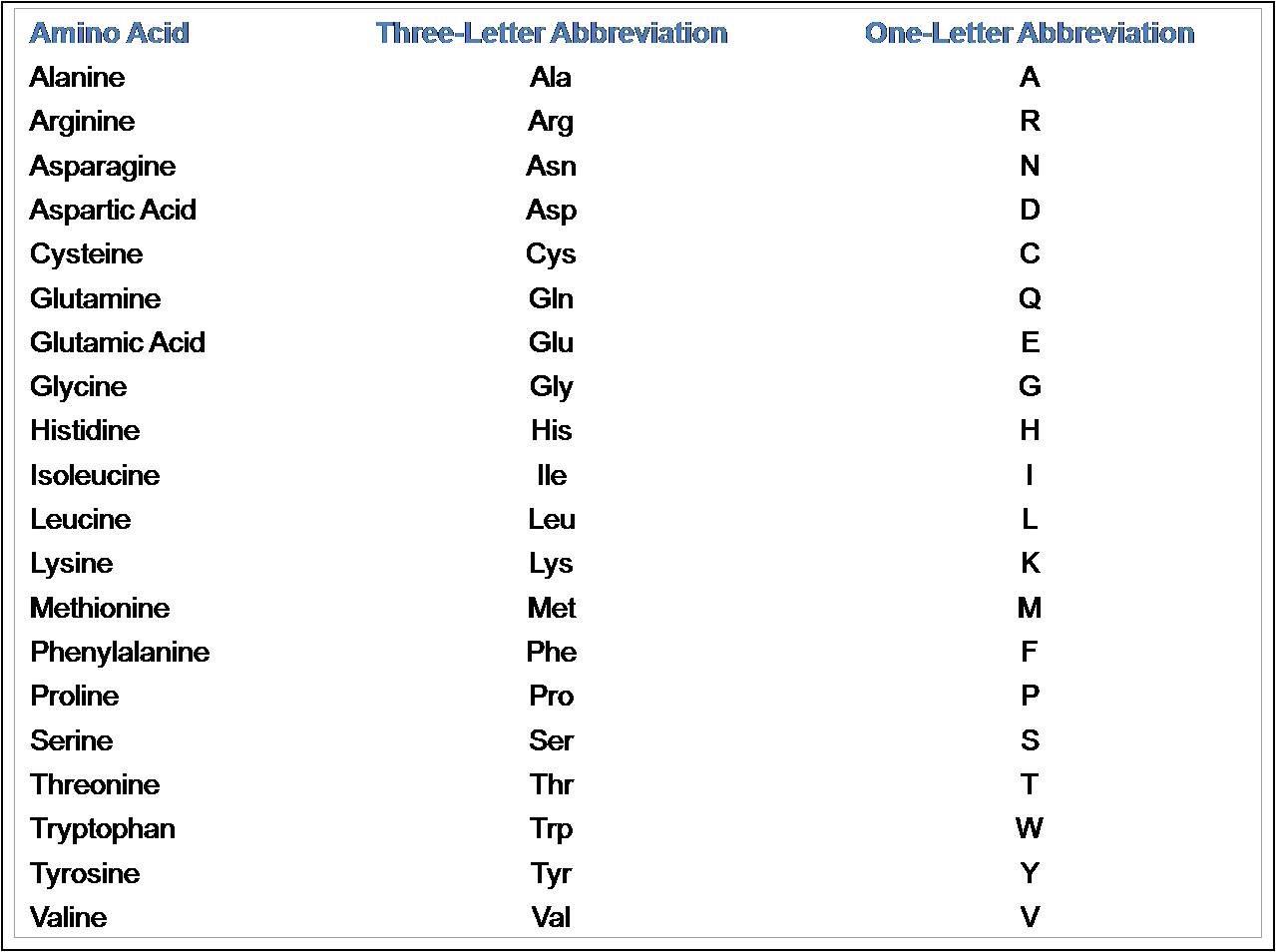
Asam amino sering dilambangkan dengan singkatan 3 huruf atau simbol 1 huruf. Singkatan untuk asam amino adalah 3 huruf pertama dari nama nya kecuali asparagin, glutamine, isoleusin, dan triptofan. Simbol untuk banyak asam amino adalah huruf pertama dari namanya, G untuk glisin dan L untuk leusin, simbol-simbol lainnya telah disepakati oleh konvensi. Singkatan dan simbol ini merupakan bagian integral dari kosakata ahli biokimia.
Bagaimana rangkaian asam amino ini menjadi bahan penyusun protein? Pertama sebagai satu set mereka sangat beragam sifat struktural dan kimianya mencakup rentang yang sangat luas, memberikan protein memberikan protein fungsi yang sangat serbaguna untuk mengambil banyak peran fungsional. Kedua, banyak dari asam amino ini mungkin tersedia dari reaksi prebiotic. Akhirnya, reaktivitas intrinsik yang berlebihan mungkin dapat menghilangkan kemungkinan asam amino lainnya. Misalnya asam amino seperti homoserine dan homosistein cenderung membentuk siklik beranggota 5 yang membatasi penggunaannya dalam protein; asam amino alternatif yang ditemukan dalam protein Serin dan sistein tidak mudah mengalami siklisasi karena cincin dalam bentuk siklusnya terlalu kecil.