Klasifikasi Protein Berdasarkan Struktur dan Fungsi
Struktur Primer: Asam Amino Dihubungkan oleh Ikatan Peptida untuk Membentuk Rantai Polipeptida
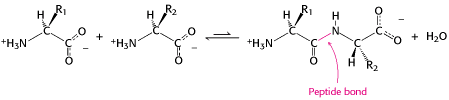
Protein adalah polimer linier yang dibentuk dengan menghubungkan gugus -karboksil dari satu asam amino ke gugus -amino dari asam amino lain dengan ikatan peptida (juga disebut ikatan amida). Pembentukan dipeptida dari dua asam amino disertai dengan hilangnya satu molekul air. Kesetimbangan reaksi ini terletak pada sisi hidrolisis daripada sintesis. Oleh karena itu, biosintesis ikatan peptida membutuhkan masukan energi bebas. Meskipun demikian, ikatan peptida cukup stabil secara kinetik; masa hidup ikatan peptida dalam larutan air tanpa adanya katalis mendekati 1000 tahun.
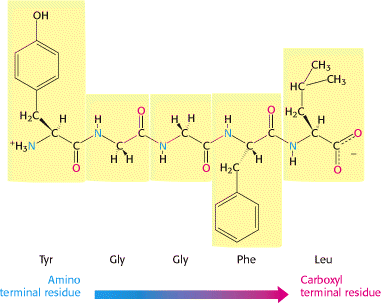
Serangkaian asam amino yang bergabung dengan ikatan peptida membentuk rantai polipeptida, dan setiap unit asam amino dalam polipeptida disebut residu. Rantai polipeptida memiliki polaritas karena ujungnya berbeda, dengan gugus -amino di satu ujung dan gugus -karboksil di ujung lainnya. Dengan konvensi, ujung amino dianggap sebagai awal dari rantai polipeptida, dan urutan asam amino dalam rantai polipeptida ditulis dimulai dengan residu aminoterminal. Jadi, dalam pentapeptide Tyr-Gly-Gly-Phe-Leu (YGGFL), fenilalanin adalah residu terminal-amino (N-terminal) dan leusin adalah residu terminal-karboksil (C-terminal). Leu-Phe-Gly-Gly-Tyr (LFGGY) adalah pentapeptida yang berbeda, dengan sifat kimia yang berbeda.
Rantai polipeptida terdiri dari bagian yang berulang secara teratur, yang disebut rantai utama atau tulang punggung, dan bagian variabel, yang terdiri dari rantai samping yang berbeda. Tulang punggung polipeptida kaya akan potensi ikatan hidrogen. Setiap residu mengandung gugus karbonil, yang merupakan akseptor ikatan hidrogen yang baik dan, dengan pengecualian prolin, gugus NH, yang merupakan donor ikatan hidrogen yang baik. Gugus-gugus ini berinteraksi satu sama lain dan dengan gugus fungsional dari rantai samping untuk menstabilkan struktur tertentu. Sebagian besar rantai polipeptida alami mengandung antara 50 dan 2000 residu asam amino dan biasanya disebut sebagai protein. Peptida yang terbuat dari sejumlah kecil asam amino disebut oligopeptida atau hanya peptida. Berat molekul rata-rata residu asam amino adalah sekitar 110, sehingga berat molekul sebagian besar protein adalah antara 5500 dan 220.000. Kita juga dapat merujuk pada massa protein, yang dinyatakan dalam satuan dalton; satu dalton sama dengan satu satuan massa atom. Sebuah protein dengan berat molekul 50.000 memiliki massa 50.000 dalton, atau 50 kd (kilodalton).
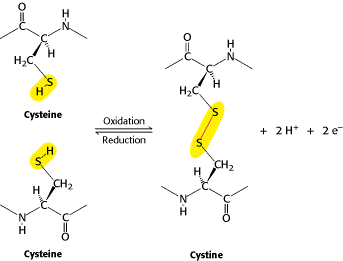
Pada beberapa protein, rantai polipeptida linier saling terkait. Ikatan silang yang paling umum adalah ikatan disulfida, yang dibentuk oleh oksidasi sepasang residu sistein. Unit yang dihasilkan dari sistein terkait disebut sistin. Protein ekstraseluler sering memiliki beberapa ikatan disulfida, sedangkan protein intraseluler biasanya tidak memiliki ikatan tersebut. Jarang, ikatan silang nondisulfida yang berasal dari rantai samping lain terdapat pada beberapa protein. Misalnya, serat kolagen dalam jaringan ikat diperkuat dengan cara ini, seperti bekuan darah fibrin.